Home > 研究成果 > p47 negatively regulates IKK activation by inducing the lysosomal degradation of polyubiquitinated NEMO.
研究成果
井上純一郎(東大医科研)
Shibata, Y., Oyama, M., Kozuka-Hata, H., Han, X., Tanaka, Y., Gohda, J. and Inoue, J.
p47 negatively regulates IKK activation by inducing the lysosomal degradation of polyubiquitinated NEMO.
Nat. Commun. 3:1061 doi:10.1038/ncomms2068 (2012).[PubMed]
NF-κB活性化経路の新たな制御機構の解明
-p47はポリユビキチン化NEMOのリソソーム分解を誘導し、IKK複合体活性化を負に制御する-
NF-κBは炎症、免疫応答や抗アポトーシスなど様々な生命現象に関わる転写因子です。その一方で、制御不全による恒常的なNF-κB活性化は炎症性疾患や癌の原因となります。そのため、NF-κB活性化の制御機構を解析することはこれら疾患の原因解明や治療に重要だと考えられます。
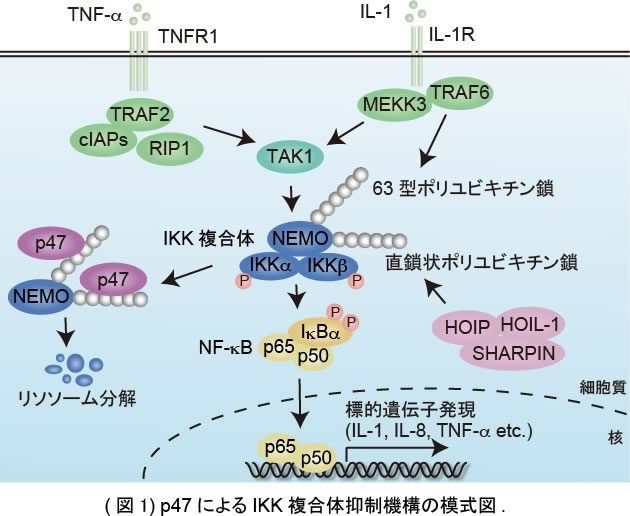
定常時、NF-κBはIκBファミリーと結合し、核移行シグナルが遮蔽された状態で細胞質内に留まっています。細胞が刺激を受けると、受容体下流のIKK複合体が活性化します。活性化したIKK複合体がIκBαのリン酸化、分解を誘導すると、NF-κBは核内に移行して標的遺伝子の転写を促進します。IKK複合体はIKKα、IKKβ、NEMOから構成されていますが、IKK複合体活性化にはNEMOの63型または直鎖状のポリユビキチン化が重要であることが明らかとなっています。これまでに、脱ユビキチン化酵素のA20やCYLDが63型、直鎖状のポリユビキチン鎖を標的にしてIKK活性化を負に制御することが知られていましたが、IKK複合体の抑制機構の全容は明らかとなっていませんでした。
そこで、IKK複合体制御に関わる新たな分子を探索するために、活性化したIKK複合体に結合する分子を質量分析法により解析しました。その結果、我々は新規IKK結合タンパク質としてp47 (NSFL1C) を同定しました。p47はATPase p97 (VCP) の補因子としてゴルジ体再構成に必須であることが知られていますが、NF-κB活性化経路における役割はわかっていませんでした。そこでまず我々は、RNAi法により内在性p47の発現を抑制するとTNF-α、IL-1によって誘導されるIKK複合体活性化、NF-κB活性化が亢進することを明らかにしました。次に、p47によるIKK複合体抑制機構を解析したところ、p47はIKK複合体構成分子のうちNEMOに結合すること、ユビキチン結合能が欠損したp47変異体はNEMOに結合することができず、NF-κB抑制能も顕著に減少することがわかりました。また、p47発現抑制やリソソーム阻害剤添加によって刺激依存的に誘導されるポリユビキチン化NEMOが蓄積すること、リソソーム阻害剤添加によりNF-κB活性化が亢進することも明らかにしました。以上の結果から、本研究においてp47はポリユビキチン化NEMOのリソソーム分解を誘導することによってIKK複合体、NF-κB活性化を負に制御するという新しいIKK複合体抑制機構を明らかにしました (図1)。さらに、本研究では、NF-κBが恒常的に活性化している成人T細胞白血病 (ATL) 細胞においてp47の発現が低下していることも明らかにしており、p47の発現低下が恒常的なNF-κB活性化、細胞悪性化につながる可能性が示唆されました。今後、今回の研究成果の癌治療への応用が期待されます。