
翻訳後修飾によるNF-κB活性化シグナルの制御機構と疾患発症との関連
 |
領域代表者/研究代表者 井上純一郎 東京大学医科学研究所・癌細胞増殖部門・分子発癌分野 http://www.traf6.com |
【研究概要】
転写因子NF-κBは、通常その抑制因子IκBと複合体を形成することにより細胞質に係留され不活化されているが、細胞外シグナルによるIκBのリン酸化とそれに続くLys48型ポリユビキチン化によりIκBがプロテアソーム依存的に分解され、NF-κBが核移行し活性化される。この時IκBをリン酸化するIκB kinase複合体(IKKα, IKKβ, NEMOで構成)の活性化には、タンパク質のLys63型ポリユビキチン化を介したシグナル複合体形成が必要であると考えられている。Lys63型ポリユビキチン鎖はタンパク質分解を誘導せず、このユビキチン鎖に結合するタンパク質群を介してシグナル複合体形成の足場となると考えられている。さらに、本領域の徳永らは、NEMOの直鎖型ポリユビキチン化がNF-κB活性化に関与することを報告している。即ち、NF-κB活性化シグナルは、3つの異なるユビキチン化反応によって制御されており、シグナル伝達の翻訳後修飾による制御という観点からも、注目を集めている。
さらに活性化されたNF-κBは、その活性化に必要なLys63型ポリユビキチン鎖や直鎖型ポリユビキチン鎖を分解する脱ユビキチン化酵素の遺伝子を発現誘導する。そのため、正常細胞においてNF-κBの活性化は、通常、負のフィードバックをうけ一過性であるが、我々は、乳癌膵癌等の固形腫瘍においてその20から40%でNF-κBが恒常的に活性化しており、その結果発現誘導された遺伝子群が癌の悪性化に関与していることを示した。また、NF-κBの活性化が、乳がん幹細胞の誘導に関与することを示唆する結果も得ている。しかし、NF-κBの恒常的活性化、NF-κBによるがん悪性化やがん幹細胞誘導の分子機構の解明は不十分である。本研究では、これらの現象の分子機構を追求しユビキチン化制御異常と癌悪性度との関係を明らかにする。恒常的活性化の要因の一つに負のフィードバックの破綻があると推定されるため、平成22年度~24年度の本研究において新たな負の制御因子を同定することを目指し、NF-κBの活性化に必須なIκBキナーゼ(IKK)複合体に結合する分子を領域内の質量分析を担当する尾山との共同研究として探索した。その結果、NF-κB活性化シグナル依存的にIKK複合体に結合するタンパク質としてp47を同定した。IKK複合体の構成因子で、その活性化に必須であるNEMOは刺激依存的にLys63型あるいは直鎖型ユビキチン鎖で翻訳後修飾されるが、p47はユビキチン鎖と結合するUBAドメインを持っており、そのドメインを介してユビキチン化NEMOに結合した。興味あることにNEMOとp47の共発現はNEMOのリソゾームでの分解を誘導した。以上の実験結果からp47は刺激依存的にユビキチン化され活性化されたNEMOをライソゾームで分解してNF-κBの活性化を負に制御する分子であると考えられた (図1)。
一方、Lys63型ポリユビキチン鎖や直鎖型ユビキチン鎖を介したシグナル複合体形成の制御機構については報告間で矛盾点も多く、まだ解明すべき多くの問題点が残されている。例えばヒトT細胞白血病ウイルスI型(HTLV-I)のタンパク質TaxによるNF-κB活性化が成人T細胞白血病(ATL) 発症に重要な役割を果たすことが報告されており、我々はTaxが種々のタンパク質のLys63型ポリユビキチン化を誘導することを見出しているがNF-κB活性化との関係は明らかでない。本研究では、このTax及びサイトカイン刺激によりE3ユビキチンリガーゼとして機能するTRAF6がNF-κBを活性化する際に形成されるLys63型ポリユビキチン鎖の役割を解析し、疾患とユビキチン化との関係を解明する。さらに本領域の石谷によるTRAF6及びTax等の構造解析情報や市川によるシグナル複合体形成の数理シミュレーションを基盤としてユビキチン化によるシグナル制御モデルを提唱する。さらに、NF-κB活性化シグナルの制御において、新規のユビキチン化タンパク質やこれまでに知られていない翻訳後修飾が関与する可能性があり、次世代質量分析計を用いてNF-κB活性化に関与する新たな翻訳後修飾を探索する。
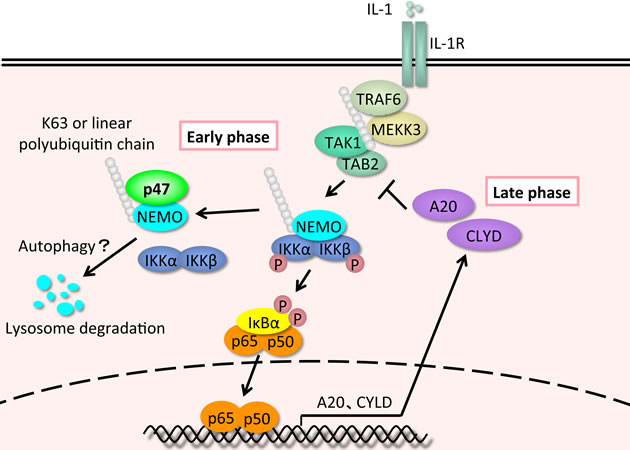
図1 p47は刺激依存的にユビキチン化され活性化されたNEMOに結合し、NEMOのライソゾームでの分解を誘導してNF-κBの活性化を負に制御する。これまでに報告されていた負の制御因子A20やCYLDがNF-κB活性化の後期に機能するのに対してp47は初期の活性化を抑制すると思われる。
【参考文献】
- Shibata, Y., Oyama, M., Kozuka-Hata, H., Han, X., Tanaka, Y., Gohda, J. and Inoue, J. p47 negatively regulates IKK activation by inducing the lysosomal degradation of polyubiquitinated NEMO. Nat. Commun.3:1061 doi:10.1038/ncomms2068 (2012).
- Taguchi, Y., Kiga, Y., Gohda, J. and Inoue, J. Identification and characterization of anti-osteoclastogenic peptides derived from the cytoplasmic tail of RANK. J. Bone Miner. Metab. 30, 543-553 (2012).
- Yamazaki, K., Gohda, J., Kanayama, A., Miyamoto, Y., Sakurai, H., Yamamoto, M., Akira, S., Hayashi, H., Su, B., and Inoue, J. Two Mechanistically and Temporally Distinct NF-κB Activation Pathways in IL-1 Signaling. Sci. Signal. 2, ra66 (2009).
- Akiyama T., Shimo Y., Yanai H., Qin J., Ohsima, D., Maruyama Y., Asaumi Y., Kitazawa J., Takayanagi H., Penninger JM., Matsumoto M., Nitta T., Takahama Y., and Inoue J. The Tumor Necrosis Factor family receptors RANK and CD40 cooperatively establish the thymic medullary microenvironment and self-tolerance. Immunity 29, 423-437 (2008).
- Gohda, J., Akiyama, T., Koga, T., Takayanagi, H., Tanaka, S., and Inoue, J. RANK-mediated amplification of TRAF6 signaling leads to NFATc1 induction during osteoclastogenesis. EMBO J 24, 790-799 (2005).
- Akiyama, T., Maeda, S., Yamane, S., Ogino, K., Kasai, M., Kajiura, F., Matsumoto, M., and Inoue, J. Dependence of Self-tolerance on TRAF6-directed Development of Thymic Stroma. Science 308 (5719), 248-251 (2005).
- Kobayashi N., Kadono Y., Naito A., Matsumoto K., Yamamoto T., Tanaka S., and Inoue J. Segregation of TRAF6-mediated signaling pathways clarifies its role in osteoclastogenesis. EMBO J. 20, 1271-1280 (2001).
- Naito, A., Azuma, S., Tanaka, S., Miyazaki, T., Takaki, S., Takatsu, K., Nakao, K., Nakamura, K., Katsuki, M., Yamamoto, T. and Inoue, J. Severe osteopetrosis, defective interleukin-1 signaling and lymph node organogenesis in TRAF6-deficient mice. Genes Cells 4, 353-362 (1999).
- Ishida, T., Tojo, T., Aoki, T., Kobayashi, N., Ohishi, T., Watanabe, T., Yamamoto, T. and Inoue, J. TRAF5, a novel tumor necrosis factor receptor-associated factor family protien, mediates CD40 signaling. Proc. Natl. Acad. Sci. USA. 93, 9437-9442 (1996).
- Ishida, T., Mizushima, S., Azuma, S., Kobayashi, N., Tojo, T., Suzuki, K., Aizawa, S., Watanabe, T., Mosialos, G., Kieff, E., Yamamoto, T. and Inoue, J. Identification of TRAF6, a novel tumor necrosis factor receptor-associated factor protein that mediates signaling from an amino-terminal domain of the CD40 cytoplasmic region. J. Biol. Chem. 271, 28745-28748 (1996).











