
Home > 研究成果 >Specific recognition of linear polyubiquitin by A20 zinc finger 7 is involved in NF-κB regulation
研究成果
| 徳永文稔(群大・生調研・分子細胞制御) 石谷隆一郎(東大・院理・生物化学) Tokunaga F.*, Nishimasu H.*, Ishitani R., Goto E., Noguchi T., Mio K., Kamei K., Ma A., Iwai K., and Nureki O. (*; equal contribution) Specific recognition of linear polyubiquitin by A20 zinc finger 7 is involved in NF-κB regulation EMBO J. 31, 3856-3870, (2012) [PubMed] Science Signaling誌、 |
群馬大学生体調節研究所の徳永班と東京大学大学院理学研究科の石谷班の研究グループは、B細胞リンパ腫発症に至る分子機構の一端を解明しました。NF-κBは細菌やウイルス、炎症性サイトカイン、紫外線など多様なストレスに応答し、炎症や免疫制御において中心的な役割を果たす転写因子です。NF-κBの活性化には直鎖状ユビキチン鎖という特殊なタイプのユビキチン鎖が関与します。今回、NF-κB経路のブレーキ役として知られているA20タンパク質が7番目のジンク(亜鉛)フィンガー領域(A20-ZF7)を介して直鎖状ユビキチン鎖に特異的に結合することでNF-κB経路を制御していることを発見しました。さらに、A20-ZF7による直鎖状ユビキチン鎖認識の分子メカニズムをX線結晶構造解析によって明らかにしました。A20の遺伝性変異はB細胞リンパ腫を引き起こし、その遺伝子多型は関節リウマチなど自己免疫疾患に関連することが知られています。本研究により、非ホジキンリンパ腫を起こすA20-ZF7の遺伝子変異によって、直鎖状ユビキチン鎖への結合やTNF(腫瘍壊死因子)受容体への会合が低下し、その結果、NF-κBの過剰活性化ががんを引き起こしている可能性が示唆されました。今回の研究成果は、B細胞リンパ腫発症の分子メカニズムの一端を解明したもので、今後抗がん剤や自己免疫疾患に対する治療薬創薬の標的としても重要な発見です。
【研究内容】
背景
NF-κBは1986年にDavid Baltimore(米国の生化学者、1975年度ノーベル生理学医学賞受賞者)らによって抗体生成に関与する転写因子として発見され、その後の研究から炎症応答や免疫制御、細胞の生存、がん細胞の接着・浸潤などに関与する多くの遺伝子発現を調節することが知られています。したがって、NF-κBの調節異常は多くのがん、クローン病など慢性炎症疾患、関節リウマチ、乾癬など自己免疫疾患、糖尿病など生活習慣病に密接に関与することが明らかになっています。NF-κBは通常、細胞質(サイトゾル)に存在しますが、細胞がストレスに曝されると核内へ移行し、標的遺伝子の発現を誘導します。この過程でユビキチン化などの翻訳後修飾が重要な役割を果たします。
ユビキチンは真核生物に高度に保存された球状タンパク質で、不要タンパク質や老廃タンパク質を分解に導く標識としてAvram Hershko(イスラエルの生化学者、2004年度ノーベル化学賞受賞)らによって発見されました。その後の研究により、ユビキチンは数珠状に連結して多様なポリユビキチン鎖を形成し、タンパク質分解のみならず、DNA修復、シグナル伝達、細胞内輸送など多彩な生理機能発現を制御していることが明らかにされています。
これまで見いだされていた7種のポリユビキチン鎖はすべて分岐鎖状ユビキチン鎖(近位ユビキチンのLys残基と遠位ユビキチンのC末端が連結したユビキチン鎖)でしたが、2006年に私たちは直鎖状ポリユビキチン鎖(近位ユビキチンのN末端と遠位ユビキチンのC末端が連結したユビキチン鎖)を生成する酵素(LUBACと命名)を発見しました。その後、LUBACが直鎖状ポリユビキチン鎖を生成することでNF-κB経路の活性化を引き起こしていることを明らかにしましが(図1)、LUBACによって活性化されるNF-κB経路の抑制メカニズムは不明でした。
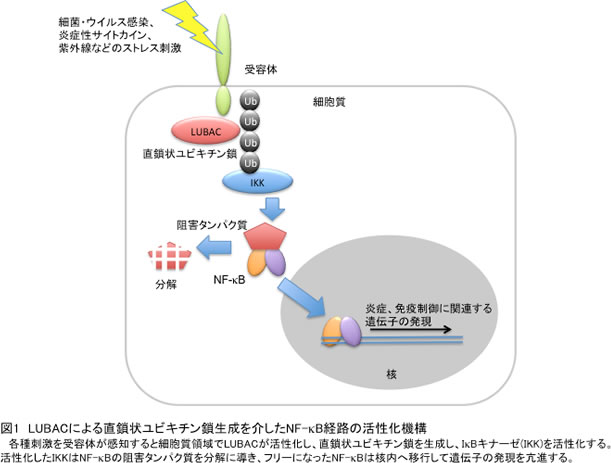
今回の発見
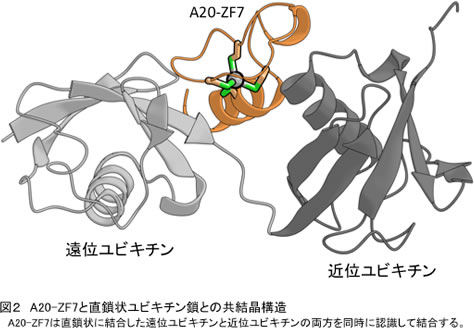
今回、LUBAC活性にブレーキを掛ける候補タンパク質として、ユビキチン分解酵素(脱ユビキチン化酵素)の影響を調べたところ、A20とCYLDがLUBACによるNF-κB活性化を抑制することがわかりました。CYLDは直鎖状ユビキチン鎖を分解することでLUBACによるNF-κB活性化を抑制した一方で、A20は直鎖状ユビキチン鎖を分解できないにもかかわらずNF-κB活性を強く抑制することを見いだしました。A20はユビキチン分解酵素領域と7つのジンクフィンガーからなるタンパク質です。そこで、NF-κB抑制に重要なA20の領域を解析したところ、7番目のジンクフィンガー(A20-ZF7)がNF-κB抑制に重要であることがわかりました。興味深いことに、A20-ZF7は分岐鎖状ユビキチン鎖には結合せず、直鎖状ユビキチン鎖に特異的に結合することがわかりました。さらに、X線結晶構造解析により、A20-ZF7が直鎖状ユビキチン鎖中の2つのユビキチン(遠位ユビキチンと近位ユビキチン)を同時に認識することで、直鎖状ユビキチン鎖に特異的に結合していることを明らかにしました(図2)。
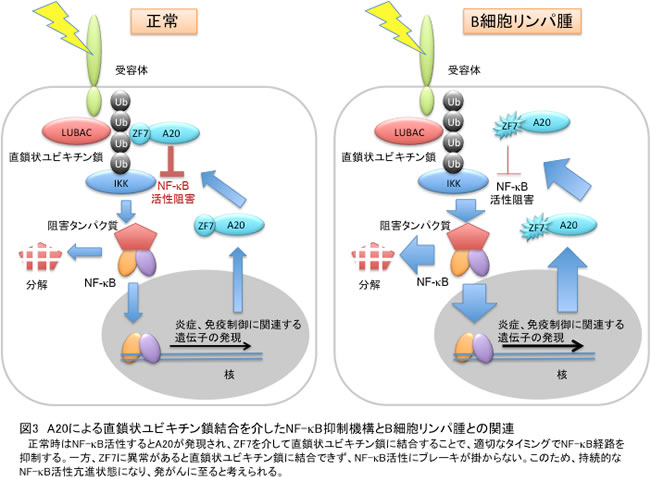
A20の遺伝性変異はB細胞リンパ腫を引き起こし、その遺伝子多型は関節リウマチ、全身性エリテマトーデス(SLE)、乾癬、糖尿病など多くの病態に関連することが知られています。特に、A20-ZF7の欠損やアミノ酸変異(N772K変異とE781D変異)が起こるとB細胞リンパ腫(ホジキン・非ホジキンリンパ腫)を惹起することが知られていましたが、その分子メカニズムは不明でした。注目すべきことに、今回決定した結晶構造中でA20-ZF7のN772とE781はともにユビキチン結合に関与しており、実際に、A20-ZF7のN772K/E781D変異体は直鎖状ユビキチン鎖との結合が減弱し、炎症刺激を感知しNF-κB活性化を発信するTNF受容体へのA20の刺激依存的会合が低下することを見いだしました。NF-κBが活性化するとブレーキタンパク質であるA20が生成され、TNF受容体へと集積することで、適切なタイミングでNF-κB活性化を抑制することが知られていました。今回の結果から、A20-ZF7の欠損や変異により直鎖状ユビキチン鎖への結合が減弱するとA20のTNF受容体への集積が不全となり、ブレーキの掛からない持続的なNF-κB活性化状態が生じることが病態発現につながることが示唆されました(図3)。
意義
B細胞リンパ腫は血液のがん、悪性リンパ腫の一種でホジキンリンパ腫と非ホジキンリンパ腫に大別され、日本では非ホジキンリンパ腫が多数を占めます。治療には4つの薬剤を併用する化学療法(CHOP療法)や分子標的薬リツキシマブ(ヒト化抗CD20抗体)が用いられていますが、今なお治療困難なケースが多々見られます。B細胞リンパ腫の遺伝性発症原因としてはA20のほかCARD11、ABIN-1/2などの遺伝子変異が知られていますが、いずれもNF-κB経路の制御に関与するタンパク質をコードしています。
今回の研究から、B細胞リンパ腫の発症機構にA20-ZF7の直鎖状ユビキチン鎖への結合が関与するという新たな知見が得られ、発症メカニズムの一端が解明されました。直鎖状ユビキチン鎖はNF-κB活性化の足場として重要ですが、ブレーキタンパク質であるA20が集積する足場としても極めて重要であることが明らかになりました。したがって、直鎖状ユビキチン鎖を標的する薬剤はNF-κB活性の特異的制御を導くことが期待され、抗がん剤、自己免疫疾患治療薬の創薬シーズとして有効であると考えられます。











