
直鎖状ポリユビキチン化修飾による新たなNF-κB活性化機構と病態との関連
 |
研究代表者 徳永文稔 群馬大学 生体調節研究所 分子細胞制御分野 http://molcellbiol.imcr.gunma-u.ac.jp/ |
【研究概要】
ユビキチンは76残基からなる低分子量タンパク質で、E1(ユビキチン活性化酵素)、E2(ユビキチン結合酵素)、E3(ユビキチンリガーゼ)の3種の酵素活性を介してE3が時空間特異的に認識した標的タンパク質のLys側鎖に結合される。タンパク質のユビキチン化修飾は、プロテアソームによるタンパク質分解、シグナル伝達、エンドサイトーシス、DNA修復など多彩な生理機能を制御する。このユビキチン化の多機能性は、ユビキチンが多様な連結様式のポリユビキチン鎖を生成可能であることが深く関与する。
我々は、 HOIL-1L、HOIP、SHARPINからなるユビキチンリガーゼ複合体が、これまでの概念を超越するユビキチンのN末端Met1を介する直鎖状ポリユビキチン鎖を生成することを見いだし、このリガーゼ複合体をLUBAC(linear ubiquitin chain assembly complex)と命名した。LUBACはTNF-αなどの炎症性サイトカイン刺激に応答して、迅速にIκBキナーゼ (IKK)の制御サブユニットであるNEMOを直鎖状ポリユビキチン化する。これが引き金となってIKKの集積と活性化を引き起こし、阻害タンパク質(IκB)をプロテアソーム分解へ導くことで古典的NF-κBシグナル伝達を惹起する(図)。最近我々は、LUBACによるNF-κB活性化を抑制する脱ユビキチン化酵素としてCYLDとA20を同定した。CYLDは直鎖状ユビキチン鎖を分解することでNF-κB活性化を阻止したが、A20は直鎖状ユビキチン鎖を分解できず、C末端7番目のZnフィンガードメイン(ZF7)を介して直鎖状ユビキチンに特異的に結合することでTNF受容体からLUBACやIKKの解離を促進し、NF-κB活性を抑制することを明らかにした(図)。さらに、石谷班との共同研究成果としてA20 ZF7-直鎖状ユビキチン複合体の結晶構造解析に成功し、A20 ZF7の詳細な直鎖状ユビキチン特異的認識機構を解明した。A20の遺伝子変異はB細胞リンパ腫を発症することが知られ、ZF7の欠失や機能不全が病態発現に深く関連する(図)。我々は非ホジキンリンパ腫を引き起こすZF7におけるアミノ酸変異(N772KとE781D)によってA20の直鎖状ユビキチン結合性が喪失することを同定した。これは直鎖状ユビキチン結合性の喪失が癌化に連関する可能性を示す。
本研究では、我々が同定した直鎖状ポリユビキチン化修飾によって惹起されるNF-κB経路の生理的役割及び癌、炎症性疾患、自己免疫疾患、生活習慣病など病態との関連についてより詳細な解析を行う。この過程で、井上・尾山班とともに高精度質量分析によって新規直鎖状ユビキチン会合タンパク質の同定を目指す。また、石谷班とは構造生物学から示唆されるタンパク質機能部位との相関の解析を進める。さらに山岡班との共同研究としてB細胞リンパ腫発症に関わるLUBAC機能の詳細な解明を行う。さらに、市川班 とともに直鎖状ユビキチン化を介したNF-κB活性制御の数理モデル構築に着手する。
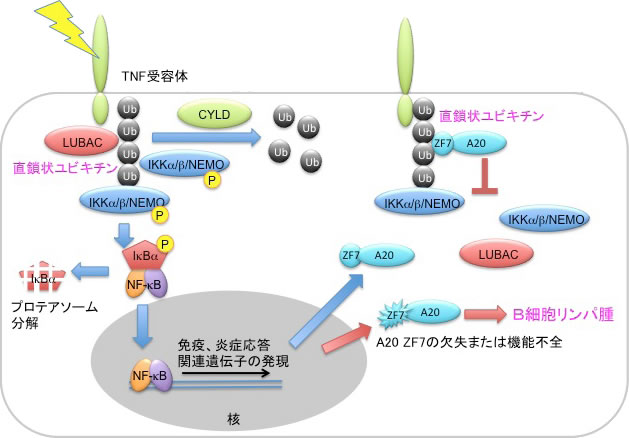
LUBACによる直鎖状ユビキチン鎖生成を介したNF-κB活性化と脱ユビキチン化酵素(CYLD、A20)による抑制機構及びB細胞リンパ腫発症との関連
【参考文献】
- Tokunaga F, Nishimasu H, Ishitani R, Goto E, Noguchi T, Mio K, Kamei K, Ma A, Iwai K, and Nureki O.: Specific recognition of linear polyubiquitin by A20 zinc finger 7 is involved in NF-κB regulation. EMBO J. 31: 3856-3870 (2012).
- Tokunaga F, and Iwai K.: A novel NF-κB regulatory mechanism for inflammatory and immune responses by the LUBAC ubiquitin ligase complex. Endocrine J. 59: 641-652 (2012).
- Tokunaga F, and Iwai K.: LUBAC, a novel ubiquitin ligase for linear ubiquitination, is crucial for inflammation and immune responses. Microbes Infect. 14: 563-572 (2012).
- Kensche T, Tokunaga F, Ikeda F, Goto E, Iwai K, and Dikic I.: Analysis of NF-κB essential modulator (NEMO) binding to linear and lysine-linked ubiquitin chains and its role in the activation of NF-κB. J. Biol. Chem. 287: 23626-23634 (2012).
- Yagi H, Ishimoto K, Hiromoto T, Fujita H, Mizushima T, Uekusa Y, Yagi-Utsumi M, Kurimoto E, Noda M, Uchiyama S, Tokunaga F, Iwai K, and Kato K.: Non-canonical UBA–UBL interaction mediates formation of linear ubiquitin chain assembly complex. EMBO Rep. 13: 462-468 (2012).
- Tokunaga F, Nakagawa T, Nakahara M, Saeki Y, Taniguchi M, Sakata S, Tanaka K, Nakano H, and Iwai K.: SHARPIN is a component of the NF-κB activating linear ubiquitin assembly complex. Nature 471: 633-636 (2011).
- Ikeda F, Lissanu Deribe Y, Skånland SS, Stieglitz B, Grabbe C, van Wijk S, Franz-Wachtel M, Goswami P, Nagy V, Terzic J, Tokunaga F, Androulidaki A, Nakagawa T, Pasparakis M, Iwai K, Sundberg JP, Schaefer L, Macek B, Rittinger K, and Dikic I.: SHARPIN forms a linear ubiquitin ligase complex regulating NF-κB activity and apoptosis. Nature 471: 637-641 (2011).
- Inn KS, Gack MU, Tokunaga F, Shi M, Wong LY, Iwai K, and Jung JU.: Linear ubiquitin assembly complex negatively regulates RIG-I- and TRIM25-mediated type I interferon induction. Mol. Cell 41: 354-365 (2011).
- Iwai K, and Tokunaga F.: Linear polyubiquitination: a new regulator of NF-κB activation. EMBO Rep. 10: 706-713 (2009).
- Tokunaga F, Sakata S, Saeki Y, Satomi Y, Kirisako T, Kamei K, Nakagawa T, Kato M, Murata S, Yamaoka S, Yamamoto M, Akira S, Takao T, Tanaka K, and Iwai K.: Involvement of linear polyubiquitylation of NEMO in NF-κB activation. Nat. Cell Biol. 11: 123-132 (2009).











