
Home > 研究成果 > SAPK pathways and p53 cooperatively regulate PLK4 activity and centrosome integrity under stress.
研究成果
| 武川睦寛(東京大・医科研・分子シグナル制御分野) Nakamura, T., Saito, H. and Takekawa, M. SAPK pathways and p53 cooperatively regulate PLK4 activity and centrosome integrity under stress. Nature Communications, 4:1775 doi:10.1038/ncomms2752, 2013 [PubMed] |
ストレス環境下における中心体数と染色体安定性の保持機構
細胞が正常に増殖するには、細胞分裂時に遺伝情報の源である染色体を2つの娘細胞に正確かつ均等に分配する必要があります。細胞が分裂する際に染色体は、微小管と中心体からなる紡錘体と呼ばれる細胞内装置によって2方向から牽引されることで、均等に分配されています(図1)。紡錘体内で微小管の重合中心となる中心体は、細胞周期のG1期には1つしかありませんが、G2期までに複製されて倍加し、M(分裂)期には紡錘体を形成する2つの極として機能することで、娘細胞への染色体の均等分配に本質的な役割を果たしています。従って、中心体を正しく複製し、その数を制御することは、細胞分裂に極めて重要であり、一方、その異常は染色体の異数化や転座の原因となることが明らかにされています。特に癌細胞では、様々なストレス刺激(DNA損傷や酸化など)に応答して中心体の過剰複製が起こることが報告されており、また中心体数の異常が癌の更なる悪性化を招いて、患者の生命予後を悪化させることも示されています。一方、正常な細胞では中心体数は厳密に制御されており、ストレス環境下でも中心体の複製異常は起こりませんが、そのメカニズムに関してはこれまでほとんど知見がありませんでした。
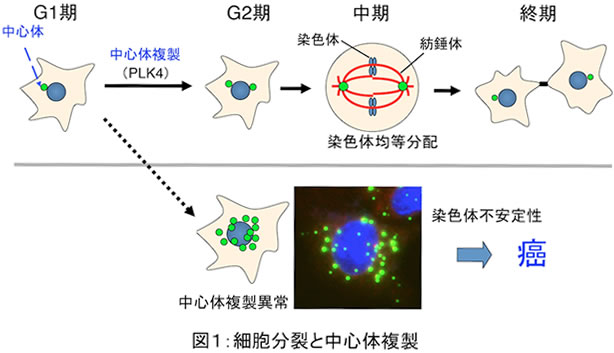
今回私達は、様々なストレス刺激に応答して活性化される2つの細胞内シグナル伝達システム、即ちストレス応答MAPキナーゼ(p38およびJNK)経路とp53経路が、協調して中心体複製の鍵分子であるPolo-like kinase 4(PLK4)の活性を調節しており、ストレス環境下での中心体複製停止と染色体安定性の保持に重要な役割を果たしていることを見出しました(図2)。
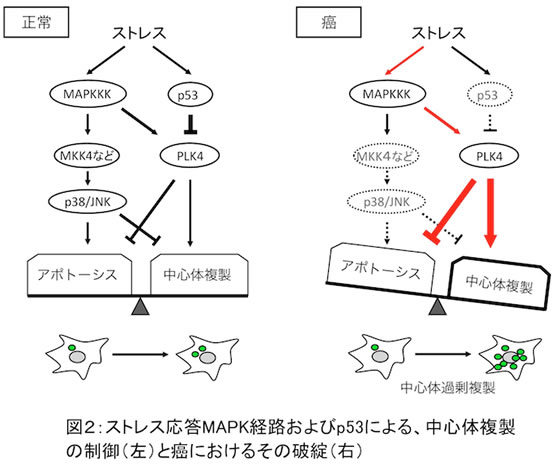
私達はまずストレス応答MAPKKKが、p38/JNK経路を活性化するのみならず、同時にPLK4をも直接リン酸化して活性化すること、また、この様なストレスによるPLK4の活性化がアポトーシス(細胞死)を防いで細胞を保護する役割を持つことを見出しました。さらに、ストレス刺激が長引くと、転写制御因子p53の発現が亢進してPLK4の転写が阻害され、その結果PLK4の発現が低下してアポトーシスが促進されることを見出しました。従ってPLK4はp53の発現が亢進するまでの間、即ちストレス応答の初期にのみ機能し、細胞死を抑制する作用を持つことが明らかになりました。
一方、これまでの研究から、PLK4が強く活性化されると中心体の過剰複製が起こり、その数が異常に増加してしまうことが知られています。そこで次に私達は、ストレス刺激によるPLK4の活性化が中心体数の異常を惹起するかどうか検討を行いました。その結果予想に反して、ストレスによってPLK4が活性化された場合には、中心体の過剰複製が殆ど起こらないことを見出し、さらにそのメカニズムとして、1)ストレス環境下でPLK4と同時に活性化されるp38/JNKが、中心体の複製を速やかに停止させること、また上述の様に2)p53がPLK4の発現を徐々に低下させて、PLK4の過剰な活性化を防いでいることを明らかにしました。即ち、ストレス環境下でp38/JNKとp53が協調して作用し、中心体の過剰複製を防御していることが明らかになりました。
興味深いことに、癌細胞ではMKK4(p38/JNK経路のMAPKK)およびp53の遺伝子変異が高頻度に認められ、さらに両者の変異が同時に起こる場合が多いことが知られています。この様な癌細胞ではp38/JNKとp53の活性化が共に阻害されており、中心体の複製制御機構が破綻している可能性が示唆されます。そこで、この可能性を検証するため、培養細胞に癌患者由来の変異型MKK4、およびp53を失活させる癌ウイルス蛋白質(ヒト・パピローマウイルスE6)を導入して、癌細胞と同様の状況を作り出したところ、DNA損傷などのストレス刺激に応じて中心体の過剰複製とそれに伴う染色体の異数化が誘導されることが確認されました(図3)。
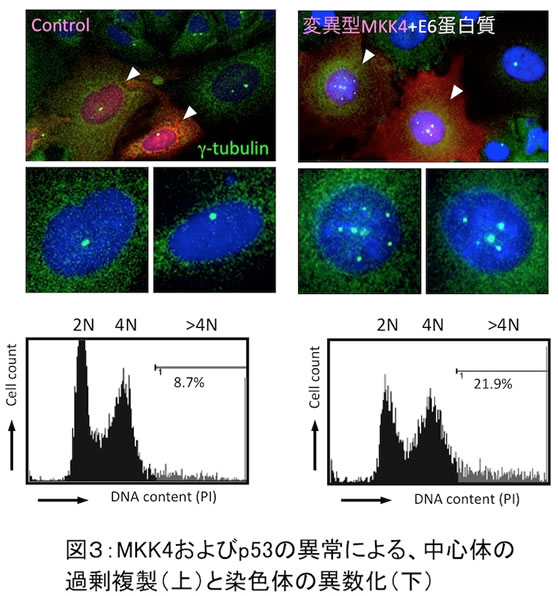
これまで、MKK4は様々な癌で遺伝子変異が認められることから、癌抑制遺伝子として機能すると考えられてきましたが、その発癌抑制メカニズムは不明でした。私達は、MKK4がストレス環境下でp53と協調して機能し、中心体の過剰複製と染色体不安定性を防御する新たなタイプの癌抑制遺伝子であることを明らかにしました。今後、今回の研究成果を応用した新たな癌治療薬の開発が期待されます。











