Home > 研究成果 > Regulation of cargo-selective endocytosis by dynamin 2 GTPase-activating protein girdin.
研究成果
| 高橋雅英(名大・院医・分子病理) Weng, L., Enomoto, A., Miyoshi, H., Takahashi, K., Asai, N., Morone, N., Jiang, P., An, J., Kato, T., Kuroda, K., Watanabe, T., Asai, M., Ishida-Takagishi, M., Murakumo, Y., Nakashima, H., Kaibuchi, K. and Takahashi, M. Regulation of cargo-selective endocytosis by dynamin 2 GTPase-activating protein girdin. EMBO J. 2014 Jul 24. pii: e201488289. [Epub ahead of print] [PubMed] |
要約
すべての細胞は、細胞外物質(栄養素等)や細胞表面の膜分子を積極的に内部に取り込む機能を有しており(エンドサイトーシス)、その分子メカニズムに関する研究が国内外で広く展開されている。各細胞がその種類や環境に応じて適切に機能するためには、栄養素や膜分子を厳密に選別して細胞内に取り込むこと(選択的エンドサイトーシス)が必要と考えられている。その機序として、取り込まれる分子(以下「カーゴ(積み荷)」と記載)の各々に選択的に結合するアダプター分子がエンドサイトーシスの選択性を制御することが明らかにされている。しかしながらアダプター分子は必ずしもカーゴ選択的ではないこと、細胞の種類や状況、およびそれらに応じて取り込まれるカーゴの種類が非常に多様であることを考えると、アダプター分子による選択は決して十分なものではなく他の機構があることも推定されていた。
今回私達はエンドサイトーシスの選択性を制御する新しいしくみとして上記のアダプター分子による選別とは異なる機構を解明したので報告する。エンドサイトーシスにおいて、細胞膜から膜小胞が分離する際に重要な働きをする分子としてdynaminが知られているが、本研究ではdynaminの新規結合分子としてGirdin(ガーディン)を同定し、dynamin・Girdin・カーゴの三者間の様々な結合の組み合わせにより、dynaminの活性制御とエンドサイトーシスの選択性が制御されていることを見出した。過去の研究でGirdinは生後脳の神経芽細胞の移動、様々な悪性腫瘍(がん)の進行、生後の血管新生に重要であることが明らかとなっており、本研究成果は選択的エンドサイトーシスを司る基本的なしくみの解明にとどまらず、精神神経疾患の発症および悪性腫瘍の進展のしくみの解明にも寄与するものと期待される。
説明
エンドサイトーシスは細胞が細胞外物質や細胞表面の膜分子を取り込むために重要であり、これにより様々な細胞機能、例えば細胞の運動、増殖、生存、および生理活性等が制御されている。細胞はその種類・状況・環境等によりこれらの取り込む分子(カーゴ)を厳密に選別する必要があり、その選択性を制御するしくみについて多くの研究が展開されてきた。その一つは、取り込まれるカーゴに選択的に結合するアダプタータンパク質複合体あるいはカーゴアダプターと呼ばれる分子群による調節である(図)。しかしながら取り込まれる細胞外物質や膜分子の種類の多様性を考えると、本機構は取り込みの選択性を厳密に決定するには不十分とされていた。例えば複数のサブユニットから構成されるヘテロ4量体のAP-2(adaptin)はアダプター分子の代表だが、トランスフェリン受容体等、極めて多くの種類のカーゴの取り込みに関わっている。アダプター分子β-arrrestinはAP-2と協調して多種多様のGタンパク質共役受容体の取り込みを、別の分子numbもインテグリンやカドヘリン等複数のカーゴの取り込みを制御することが知られている。今回私達は上記とは異なる選択的エンドサイトーシスの機序を報告したので以下に概説する。
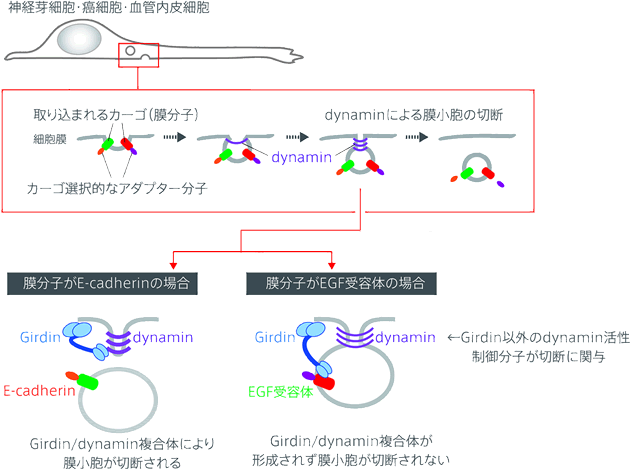
細胞がエンドサイトーシスにおいてカーゴを取り込むためには、まず細胞膜が内側にくびれ、その後膜小胞として細胞膜と遊離する必要がある(図)。細胞膜の遊離に重要な働きをする分子としてdynamin GTPase(以下dynamin)が知られているが、今回、私達はdynaminの新規結合分子としてGirdinを同定した。Girdinはアクチン結合タンパク質としてこれまで私達が研究をすすめてきた分子であり、今回の生化学的解析によりGirdinがdynaminと直接結合し、dynaminのGTPase活性を上昇させることを明らかにした。Girdinのdynaminに対する結合の責任ドメインはGirdinのN末端ドメインであり、同ドメインを介したdynamin/Girdin間の結合が膜小胞の切断に重要な働きをすることを明らかにした。
以前の研究により、Girdinは上皮増殖因子受容体(epidermal growth factor receptor、以下EGFR)と結合することが明らかにされている。今回の検討によりGirdinのN末端ドメインがEGFRと結合するとdynamin/Girdinの複合体形成が競合的に阻害され、従ってdynaminの活性が上昇せず、結果的に膜小胞の切断が抑制されることを明らかにした(図)。これと同様の機構でインテグリンを含む膜小胞の切断もGirdinは制御することができない。一方、トランスフェリン受容体やE-cadherin等のカーゴを含む膜小胞の場合、Girdinはこれらのカーゴと結合せず、従ってdynamin/Girdin複合体が形成されることで膜小胞の切断が促進されることを明らかにした(図)。
今回明らかにされた選択的エンドサイトーシスの機序について疑問点も残されている。その一つは、dynaminによる膜小胞の切断の時点でカーゴを区別するのは、選別のタイミングとしては遅すぎるのではないかという指摘である。この点に関して私達は明解な解答を得ていないが、全反射照明蛍光顕微鏡(total internal reflection fluorescence microscope; TIRFM)を用いた実験結果から、Girdinがエンドサイトーシスの過程の極初期から膜小胞(厳密にはクラスリン被覆ピット)に局在していることが明らかとなった。また興味深いことにGirdinはディッシュ上に接着した細胞底面の辺縁ではなく中心部のエンドサイトーシスを特異的に制御することが判明した。これはエンドサイトーシスの初期の段階からGirdinが選択性の制御に関わっている可能性を示唆するものである。このことからGirdinは(1)エンドサイトーシスの初期から膜小胞の形成部位の決定に関与し、かつ上述した(2)dynamin・Girdin・カーゴの三者間の様々な結合の組み合わせによるdynaminの活性制御、という二つの機序によってエンドサイトーシスの選択性を制御している可能性を考えている。
もう一点の問題点は、Girdinが膜小胞切断に関与しないEGFRやインテグリン等の場合はどのように膜小胞が切断されるのか、という疑問である。dynaminは内在性のGTPase活性を有する他、Girdin以外にもdynaminの活性を制御する分子は過去に報告されている。現時点の仮説として、私達は細胞の種類や状況によって複数のdynamin活性制御分子が膜小胞切断に関わり、そこで今回示したような分子間結合の競合メカニズムが働くことによって多様なカーゴの選択性が保証されているのではないかと推測している。
上記の研究結果は、アダプター分子群による選別とは別の選択的エンドサイトーシスのしくみがあることを示しており、細胞の種類や状況に特異的な細胞活動や機能に重要であると考えている。過去の研究により、Girdinは海馬歯状回や脳室下帯で産生される神経芽細胞の移動、乳がんや脳腫瘍の進展、生後の血管新生に関わることが知られており、今後はこのような細胞の機能あるいは疾患の発症において、今回報告したエンドサイトーシスのしくみがどのように関わっているか検討する予定である。
尚、本研究は聖マリアンナ医科大学、京都大学・物質−細胞統合システム拠点、名古屋大学大学院医学系研究科細胞情報薬理学との共同研究である。
【図の説明文】
細胞の底面において各々のカーゴ(膜分子)がエンドサイトーシスによって取り込まれる過程を示す。これまで細胞内に取り込まれるカーゴの選択性はそれぞれに結合するアダプター分子によって説明されてきた。Girdinはdynaminに結合し、そのGTPase活性を制御することで膜小胞の切断に寄与する。カーゴがEGF受容体の場合、GirdinはEGF受容体に結合するためdynaminに結合することができず、従って膜小胞の切断することはできない。一方カーゴがE-cadherinの場合、Girdinはこれに対する結合性を示さず、従ってdynaminと複合体を形成することで膜小胞切断を促進することが可能である。EGF受容体を有する膜小胞の切断ではGirdinとは別のdynamin制御因子が複数関与していると推定しているが詳細は未解明である。