
Aktキナーゼによるアクチン結合蛋白Girdinのリン酸化修飾と疾患
 |
代表研究者 高橋雅英 名古屋大学大学院医学系研究科・分子病理 http://www.med.nagoya-u.ac.jp/patho2/ |
 |
分担研究者 榎本 篤 名古屋大学高等研究院・講師 |
【研究概要】
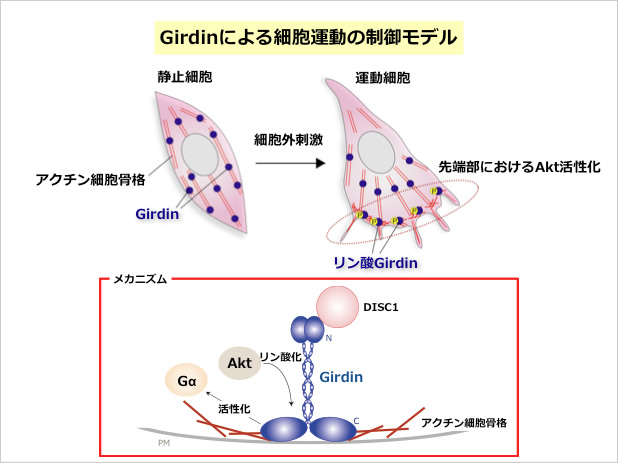
セリン・スレオニンキナーゼであるAktは増殖因子など様々な細胞外からの刺激により活性化され、細胞増殖、生存、代謝など細胞機能に重要な役割を果たすことが知られている。また近年Aktが、白血球、線維芽細胞、血管内皮細胞、がん細胞の運動に重要であることが示され、特にAktの発現の高い癌では悪性度が高く、予後が悪いと報告されるようになった。しかしながらAktの活性化がどのようなメカニズムで細胞運動を促進するかについては、がんの治療法の開発にも直結する重要な課題であるにもかかわらず、長年不明であった。われわれは、酵母two-hybrid法を用いたスクリーニングにより、Aktの新規基質であるGirdin (Girders of actin filamentの略)を発見し、GirdinがAktの下流で細胞運動に重要な役割を果たしていることを明らかにした(Enomoto et al., Dev. Cell, 2005)。機能解析によりGirdinが新規アクチン結合蛋白であり、Aktによってリン酸化を受けるとアクチン線維の再構成を生じ、細胞運動に重要な役割を果たす細胞先導端のラメリポディアの形成に関与していることを証明した。Girdinの発現をノックダウンしたり、Aktによるリン酸化部位に変異を導入したGirdinを発現させたりすると、形態異常と著明な細胞運動能の低下を生じ、Akt-Girdinシグナル系の細胞運動における重要性が明らかになった。さらにGirdinが一部のがん細胞において高い発現を示し、がん細胞株でGirdinの発現をノックダウンするとがん細胞の転移能を著しく低下させることが判明した。
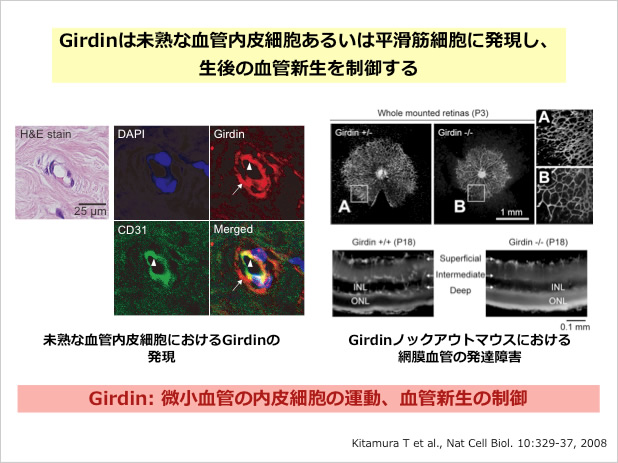
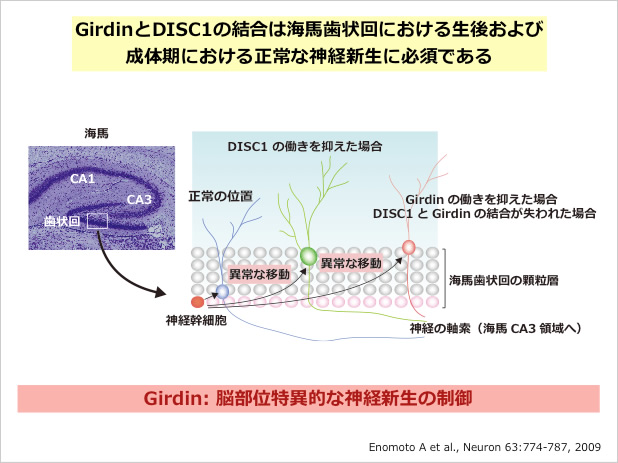
また、Girdinは生体内では未熟な血管内皮細胞、周皮細胞や海馬の神経細胞、嗅球の形成に重要な脳室下帯やrostral migratory stream(以下RMS)を構成する神経細胞で強く発現していた。Girdinのノックアウトマウスを作製し、生体内における役割を解析した結果、ノックアウトマウスは生後直後においては野生型の間に明瞭な肉眼的な変化を認めないものの、組織学的には生後形成される網膜および大脳の血管ネットワークと海馬および嗅球の構造異常が認められた(Kitamura et al., Nature Cell Biol.2008; Enomoto et al., Neuron 2009)。この結果は、Girdinは胎生期における脈管形成(vasculogenesis)や器官形成(organogenesis)においてではなく、生後の血管新生と神経発生(postnatal angiogenesis and neurogenesis)において重要な役割を果たす分子であることを示した。血管新生にはVEGFによるAkt活性化と、それに引き続くAktによるGiridinのリン酸化が重要であった(Nature Cell Biol. 2008)。一方、神経細胞ではGirdinが統合失調症や双極性障害(躁うつ病)の脆弱因子として最近注目されているDISC1(Disrupted-In- Schizophrenia 1)と分子複合体を形成し、海馬における新生ニューロンの移動と分化を制御していることを示す結果を得た(Neuron 2009)。
以上の知見に基づき、本研究ではGirdinとそのリン酸化修飾の役割について、がん細胞の浸潤・転移、血管新生の制御(腫瘍血管、網膜疾患との関連性)、神経新生と神経疾患の病態との関連に注目して、細胞レベル、個体レベルの解析を進める。
【参考文献】
- Enomoto, A., Murakami, H., Asai, N., Morone, N., Watanabe, T., Kawai, K., Murakumo, Y., Usukura, J., Kaibuchi, K. and Takahashi, M.
Akt/PKB regulates actin organization and cell motility via Girdin/APE.
Dev. Cell 9: 389-402 (2005). - Jiang, P., Enomoto, A., Jijiwa, M., Kato, T., Hasegawa, T., Ishida, M., Sato, T., Asai, N., Murakumo, Y. and Takahashi, M.
An actin-binding protein Girdin regulates the motility of breast cancer cells.
Cancer Res., 68:1310-1318 (2008). - Kitamura, T., Asai, N., Enomoto, A., Maeda, K., Kato, T., Ishida, M., Jiang, P., Watanabe, T., Usukura, J., Kondo, T., Costantini, F., Murohara, T. and Takahashi, M.
Regulation of VEGF-mediated angiogenesis by the Akt/PKB substrate Girdin.
Nature Cell Biol., 10:329-337 (2008). - Enomoto, A., Asai, N., Namba, T., Wang, Y., Kato, T., Tanaka, M., Tatsumi, H., Taya, S., Tsuboi, D., Kuroda, K., Kaneko, N., Sawamoto, K., Miyamoto, R., Jijiwa, M., Murakumo, Y., Sokabe, M., Seki, T., Kaibuchi, K. and Takahashi, M.
Roles of Disrupted-in-Schizophrenia 1-interacting protein Girdin in postnatal development of the dentate gyrus.
Neuron 63: 774-787 (2009). - Matsushita, E., Asai, N., Enomoto, A., Kawamoto, Y., Kato, T., Mii, S., Maeda, K., Shibata, R., Hattori, S., Hagikura, M., Takahashi, k., Sokabe, M., Murakumo, Y., Murohara, T. and Takahashi, M.
Protective role of Gipie, a Girdin family protein, in endoplasmic reticulum stress responses in endothelial cells.
Mol. Biol. Cell. 22: 736-747 (2011). - Miyake, H., Maeda, K., Asai, N., Shibata, R., Ichimiya, H., Isotani-Sakakibara, M., Yamamura, Y., Kato, K., Enomoto, A., Takahashi, M. and Murohara, T.
The actin-binding protein Girdin and its Akt-mediated phosphorylation regulate neointima formation after vascular injury.
Circ. Res. 108: 1170-1179 (2011). - Wang, Y., Kaneko, N., Asai, N., Enomoto, A., Isotani-Sakakibara, M., Kato, T., Asai, M., Murakumo, Y., Ota, H., Hikita, T., Namba, T., Kuroda, K., Kaibuchi, K., Ming, G., Song, H., Sawamoto, K. and Takahashi, M.
Girdin is an intrinsic regulator of neuroblast chain migration in the rostral migratory stream of the postnatal brain.
J. Neurosci. 31: 8109-8122 (2011). - Natsume, A., Kato, T., Kinjo, S., Enomoto, A., Toda, H., Shimato, S., Ohka, F., Motomura, K., Kondo, Y., Miyata, T., Takahashi, M. and Wakabayashi, T.
Girdin maintains the stemness of glioblastoma stem cells.
Oncogene 31: 2715-2724 (2012).. - Ishida-Takagishi, M., Enomoto, A., Asai, N., Ushida, K., Watanabe, T., Hashimoto, T., Kato, T., Weng, L., Matsumoto, S., Asai, M., Murakumo, y., Kaibuchi, K., Kikuchi, A. and Takahashi, M.
The Dishevelled-associating protein Daple controls the non-canonical Wnt/Rac pathway and cell motility.
Nature Commun. 3: 859 (2012). - Ito, T., Komeima, K., Yasuma, T., Enomoto, A., Asai, N., Iwase, S., Takahashi, M. and Terasaki, H.
Girdin and its phosphorylation dynamically regulate neonatal vascular development and pathological neovascularization in the retina.
Am. J. Pathol. 182: 586-596 (2013).











