
Home > 研究成果 > Hipk2 and PP1c cooperate to maintain Dvl protein levels required for Wnt signal transduction.
研究成果
| 石谷 太(九州大学・生体防御医学研究所) Shimizu N, Ishitani S, Sato A, Shibuya H, *Ishitani T Hipk2 and PP1c cooperate to maintain Dvl protein levels required for Wnt signal transduction. Cell Reports, 2014 [URL] [PubMed] |
発がんに関与する細胞内情報伝達分子Dvlの新規調節機構を解明
九州大学生体防御医学研究所の清水誠之研究員、石谷准教授らは、発がんに関与する細胞内情報伝達分子“Dishevelled (Dvl)”の新規調節機構を解明しました。この研究成果は、2014年8月21日にCell Reports誌電子板で発表されました。
研究の背景
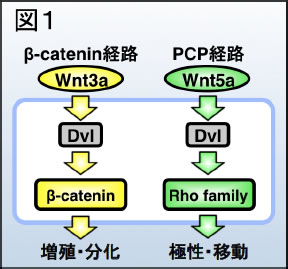 細胞外情報伝達分子Wntは、動物の個体発生と恒常性の維持において、細胞の増殖・分化・極性・移動を制御します。Wntの情報伝達の破綻は、種々の先天性の疾患やがんなどの成人病の発症の原因となります。哺乳類では19種類のWnt分子が同定されており、Wnt3aファミリーとWnt5aファミリーの二つに大別されます。細胞はWnt3aファミリーの分子を受容すると、その情報を細胞内情報伝達分子Dishevelled(Dvl)タンパク質へと伝えます(図1左)。これにより活性化したDvlはβ-catenin経路を活性化します。β-catenin経路が活性化すると、細胞質中でβ-cateninタンパク質の安定化が起き、結果として細胞の増殖や分化が誘導されます。一方、細胞がWnt5aファミリーの分子を受容した場合も、Dvlが活性化しますが、Wnt5aの下流で活性化したDvlはPCP経路を活性化します。PCP経路が活性化すると、Rhoファミリーの低分子量Gタンパク質群の活性調節が起き、結果として細胞の極性や移動が制御されます(図1右)。このように、Dvlは、Wntシグナルをβ-catenin経路とPCP経路に振り分ける、Wntシグナルの“HUB”分子です。興味深いことに、様々な腫瘍組織においてDvlタンパク質の増加とそれに伴うWntシグナルの異常活性化が観察されており、このことから、Dvlのタンパク質安定性の厳密な制御がWntシグナルの制御と組織恒常性維持に必須であると推測されています。しかしながら、Dvlの安定性制御機構は未だによくわかっていません。
細胞外情報伝達分子Wntは、動物の個体発生と恒常性の維持において、細胞の増殖・分化・極性・移動を制御します。Wntの情報伝達の破綻は、種々の先天性の疾患やがんなどの成人病の発症の原因となります。哺乳類では19種類のWnt分子が同定されており、Wnt3aファミリーとWnt5aファミリーの二つに大別されます。細胞はWnt3aファミリーの分子を受容すると、その情報を細胞内情報伝達分子Dishevelled(Dvl)タンパク質へと伝えます(図1左)。これにより活性化したDvlはβ-catenin経路を活性化します。β-catenin経路が活性化すると、細胞質中でβ-cateninタンパク質の安定化が起き、結果として細胞の増殖や分化が誘導されます。一方、細胞がWnt5aファミリーの分子を受容した場合も、Dvlが活性化しますが、Wnt5aの下流で活性化したDvlはPCP経路を活性化します。PCP経路が活性化すると、Rhoファミリーの低分子量Gタンパク質群の活性調節が起き、結果として細胞の極性や移動が制御されます(図1右)。このように、Dvlは、Wntシグナルをβ-catenin経路とPCP経路に振り分ける、Wntシグナルの“HUB”分子です。興味深いことに、様々な腫瘍組織においてDvlタンパク質の増加とそれに伴うWntシグナルの異常活性化が観察されており、このことから、Dvlのタンパク質安定性の厳密な制御がWntシグナルの制御と組織恒常性維持に必須であると推測されています。しかしながら、Dvlの安定性制御機構は未だによくわかっていません。
一方、私たちは以前に、ヒト培養細胞株HeLaを用いた解析により、β-catenin経路の正の制御因子としてタンパク質リン酸化酵素Hipk2を見つけていました。しかしながら、Hipk2によるβ-catenin経路促進機構の詳細やこの制御の生理学的意義は不明でした。
研究の成果
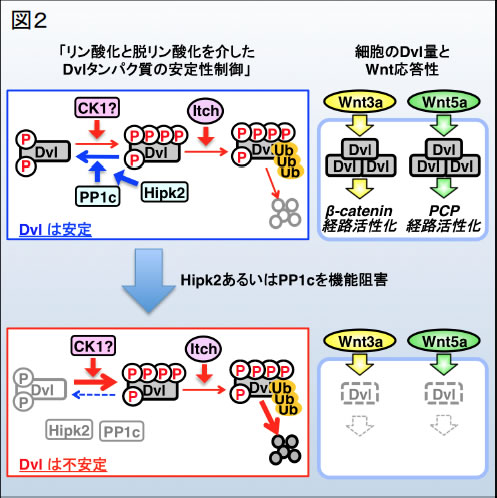
私たちはまず、モデル脊椎動物ゼブラフィッシュを用いて、Hipk2の生理機能を解析しました。Hipk2遺伝子の機能を阻害したゼブラフィッシュ胚では、胚発生過程を通じてWnt/β-catenin経路の標的遺伝子の発現の低下や、β-catenin経路によって制御されるシュペーマンオーガナイザーの形成や脳の後方化などの現象が全て異常になっていました。また意外なことに、Hipk2機能阻害胚では、Wnt/PCP経路によって制御される原腸胚形態形成運動にも異常が観察されました。これらの結果は、Hipk2が脊椎動物初期胚発生過程におけるβ-catenin経路とPCP経路の双方の活性化に必要であることを示しています。詳細な解析の結果、Hipk2機能阻害胚ではβ-catenin経路とPCP経路の共通の制御因子であるDvlタンパク質が劇的に減少していることが明らかになりました。つまり、Hipk2機能阻害胚では、Dvlタンパク質が失われているために、β-catenin経路とPCP経路双方の情報伝達に異常が生じたと推測されます(図2右)。
続いて、ヒト培養細胞株HeLaを用いてHipk2とDvlの関係を解析しました。その結果、HeLa細胞においてもHipk2をRNAiするとDvlタンパク質が減少すること、すなわち、ヒト細胞においても、Hipk2がDvlタンパク質の安定性に必須であることを見いだしました。
次に、Hipk2によるDvlの制御機構を生化学的手法を交えて解析しました。その結果、「Hipk2がDvlに結合し、Hipkがその酵素活性非依存的にタンパク質脱リン酸化酵素PP1cをDvlへとリクルートすること」と、「リクルートされたPP1cがDvlのC末端領域のCasein Kinase 1(CK1)リン酸化部位を脱リン酸化すること」、「この脱リン酸化が、ユビキチンリガーゼItchによるDvlのユビキチン化を阻害し、Dvlを安定化へと導くこと」を見いだしました(図2左)。この仮説と合致するように、PP1cを機能阻害したゼブラフィッシュやHeLa細胞では、Dvlタンパク質の減少が起き、β-catenin経路やPCP経路の伝達が低下しました(図2右)。また、Hipk2機能阻害によるDvlの減少とβ-catenin経路の活性低下は、Itchを同時に阻害することで回復しました。
最後に、Hipk2によるDvlの脱リン酸化部位を同定し、その部位をアラニン残基に置換したDvl 3A変異体(脱リン酸化状態のDvlの状態をミミックする変異体)を作製し、これを用いて、Hipk2がDvlの脱リン酸化を介してWntシグナルを制御しているのかを検討しました。Hipk2をRNAiしたHeLa細胞やHipk2を機能阻害したゼブラフィッシュ胚に野生型のDvlを発現させても、これが不安定なために、Hipk2阻害により生じるβ-catenin経路の活性低下を回復させることは出来ませんでしたが、Dvl 3A変異体を発現させた場合は、β-catenin経路の活性の回復が起きました。このことは、Hipk2がDvlの脱リン酸化と安定化を介してWntシグナルを正に制御することを示唆します。
このように、Wnt分子の細胞内情報伝達を支える、新たな情報伝達機構が明らかになりました。本発見により、Dvlタンパク質の安定性に作用するがん治療薬の開発など、新たながん治療法への道が開けると期待できます。











