
組織の維持・破綻におけるWntシグナルの状況依存的な翻訳後修飾制御
 |
研究代表者 石谷 太 九州大学生体防御医学研究所細胞統御システム分野 http://www.bioreg.kyushu-u.ac.jp/labo/crs/top.html |
【研究概要】
Wntシグナルは、細胞の増殖、分化、生存を制御するシグナル伝達経路であり、私たちの体を構成するほぼ全ての組織・臓器の構築と維持に貢献している。その一方で、Wntシグナルは、がんなどの種々の疾病の発症にも深く関与する。
Wntシグナルは、βカテニンタンパク質の細胞質中における量を調節することにより標的遺伝子の発現を制御する。Wntシグナルが活動していない細胞では、細胞質中のβカテニンは “分解装置”によってユビキチン化され、その結果としてプロテアソームによって分解される。細胞が細胞間情報伝達分子Wntを受容すると、そのシグナルは細胞膜に存在する受容体を介してDvlタンパク質に伝達され、続いてDvlは分解装置の活性を抑制する。その結果として細胞質中のβカテニンは安定化し、核内に移行する。βカテニンは核内で転写因子TCF/LEF と複合体を形成し、標的遺伝子の転写を活性化する。この経路は、全ての生物種・細胞種で機能する普遍的な経路であり、体の構築と維持の過程でくり返し働いている。
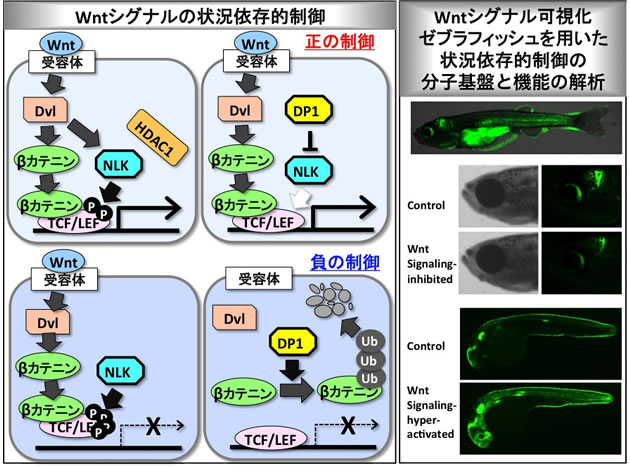
私は、翻訳後修飾によるシグナル制御を14年間継続的に解析しており、これまでに翻訳後修飾によりWntシグナルを制御する分子群を多数発見した。そして、その機能解析を行う過程で、NLKやDP1などが、細胞の種類や状況に応じて、異なる様式でWntシグナルの翻訳後修飾制御を行うことを発見した (左図)。NLKは、TCF/LEFをリン酸化する酵素であるが、NLKによるTCF/LEFリン酸化は、ヒト細胞株HEK293においてはTCF/LEFのDNA結合を阻害してWntシグナルを負に制御し(Ishitani et al., Nature, 1999)、一方で、ゼブラフィッシュ中脳の神経前駆細胞や、哺乳動物の神経前駆細胞様細胞株においてはTCF/LEFとHDAC1の結合を阻害することでWntシグナルを正に制御する(Ota et al., EMBO J 2012)。DP1はWnt分子を受容していないHEK293細胞では細胞質でβカテニンのユビキチン化を促してWntシグナル標的遺伝子の発現を負に制御し、Wnt分子を受容しているHEK293細胞では核内でNLKによるTCF/LEFリン酸化を抑制することでTCF/LEFによるWntシグナル標的遺伝子の発現を正に制御する(Kim et al., EMBO J 2012)。加えて最近、疾患におけるNLKによるWntシグナル制御も状況依存的であることも明らかになりつつある。例えば、肝細胞がんではNLKの発現亢進がおきており、肝細胞がん細胞株でNLKがWntシグナルと細胞増殖の双方を正に制御することが報告されているが(Jung et al., J Cell Biochem 2010)、一方で、脳腫瘍の一種であるグリオーマの細胞株においてはNLKはWntシグナルと細胞増殖を負に制御する(Wang et al., Neuro Oncol 2013)。これらの発見は、個体発生や疾患発症の過程におけるWntシグナルの翻訳後修飾制御が組織や細胞の種類や状況に応じて異なることを示している。Wntシグナルは多様な組織・臓器の構築や疾患に関わっているため、細胞・組織特異的なWntシグナルの翻訳後修飾制御の解明は、組織・臓器ごとの構築機構の理解や、特定の細胞・組織を標的とした疾病治療戦略の開発において重要であると考えられる。しかしながら、細胞・組織の状況に依存したWntシグナル翻訳後修飾制御に注目した研究は、ほとんど前例がなく、その分子基盤や組織の構築・破綻における機能は大部分が未解明である。そこで本研究では、Wntシグナルの状況依存的な翻訳後修飾制御の分子基盤、及び、状況依存的なWntシグナル制御の組織・臓器の構築・維持における機能とその破綻による疾患発症機構を解析する。特に本研究では、独自開発したWntシグナル可視化ゼブラフィッシュを活用することで、in vivoにおける様々な状況ごとのWntシグナル制御の分子機構と意義を明確に解明する。
【参考文献】
- Ota S, Ishitani S, Shimizu N, Matsumoto K, Itoh M, *Ishitani T : NLK positively regulates Wnt/β-catenin signalling by phosphorylating LEF1 in neural progenitor cells.
EMBO Journal 31: 1904-15, 2012 - Shimizu N, Kawakami K, *Ishitani T : Visualization and exploration of Tcf/Lef function using a highly responsive Wnt/β-catenin signaling-reporter transgenic zebrafish.
Developmental Biology 370: 71-85, 2012 - Kim WT, Kim H, Katanaev VL, Joon Lee S, Ishitani T, Cha B, Han JK, *Jho EH: Dual functions of DP1 promote biphasic Wnt-on and Wnt-off states during anteroposterior neural patterning.
EMBO Journal 31: 3384-97, 2012 - Ishitani S, Inaba K, Matsumoto K, *Ishitani T: Homo-dimerization of Nemo-like kinase is essential for activation and nuclear localization.
Molecular Biology of the Cell 22: 266-77, 2011 - Lee W, Swarup S, Chen J, Ishitani T,*Verheyen EM: Homeodomain-interacting protein kinases (Hipks) promote Wnt/Wg signaling through stabilization of b-catenin/Arm and stimulation of target gene expression.
Development 136: 241-51, 2009 - Ishitani T, Matsumoto K, Chitnis AB, *Itoh M : Nrarp functions to modulate neural crest cell differentiation by regulating LEF1 protein stability.
Nature Cell Biology 7: 1106-12, 2005 - Ishitani T, Ninomiya-Tsuji J, *Matsumoto K: Regulation of lymphoid enhancer factor 1/T-cell factor by mitogen-activated protein kinase-related Nemo-like kinase-dependent phosphorylation in Wnt/beta-catenin signaling.
Molecular and Cellular Biology 23: 1379-89, 2003a - Ishitani T, Kishida S, Hyodo-Miura J, Ueno N, Yasuda J, Waterman M, Shibuya H, Moon RT, Ninomiya-Tsuji J, *Matsumoto K: The TAK1-NLK mitogen-activated protein kinase cascade functions in the Wnt-5a/Ca(2+) pathway to antagonize Wnt/beta-catenin signaling.
Molecular and Cellular Biology 23: 131-9, 2003b - Ishitani T, Ninomiya-Tsuji J, Nagai S, Nishita M, Meneghini M, Barker N, Waterman M, Bowerman B, Clevers H, Shibuya H, *Matsumoto K: The TAK1-NLK-MAPK-related pathway antagonizes signalling between beta-catenin and transcription factor TCF.
Nature 399: 798-802, 1999 - Meneghini MD, Ishitani T, Carter JC, Hisamoto N, Ninomiya-Tsuji J, Thorpe CJ, Hamill DR, Matsumoto K, Bowerman B.: MAP kinase and Wnt pathways converge to downregulate an HMG-domain repressor in Caenorhabditis elegans.
Nature 399: 793-7, 1999











