
Home > 研究成果 > Structures of CYLD USP with Met1- or Lys63-linked diubiquitin reveal mechanisms for dual specificity
CYLDによるMet1およびLys63結合型ユビキチン鎖特異的切断メカニズムの解明
佐藤裕介(東大・構造生物)
Yusuke Sato, Eiji Goto, Yuri Shibata, Yuji Kubota, Atsushi Yamagata, Sakurako Goto-Ito, Keiko Kubota, Jun-ichiro Inoue, Mutsuhiro Takekawa, Fuminori Tokunaga and Shuya Fukai
Structures of CYLD USP with Met1- or Lys63-linked diubiquitin reveal mechanisms for dual specificity.
Nat. Struct. Mol. Biol. (2015) doi:10.1038/nsmb.2970 [URL] [PubMed]
要約
TNF-αなどの炎症性サイトカイン刺激により細胞内にはMet1およびLys63結合型ユビキチン(Ub)鎖が合成され、JNKやNF-κB伝達経路が活性化される。家族性円柱腫症の原因遺伝子として同定されたCYLDは、Met1およびLys63結合型Ub鎖を特異的に切断することでシグナル伝達経路の過剰な活性化を阻害し、腫瘍や癌を抑制する。本研究ではCYLDのUSPドメインとMet1結合型Ub2量体(Met1-Ub2)、およびCYLDのUSPドメインとLys63結合型Ub2量体(Lys63-Ub2)の結晶構造を決定することで、CYLDが2種類のポリユビキチン鎖に対応してわずかに構造を変化させて、ポリユビキチン鎖を切断するメカニズムを明らかにした。
研究の背景
Ubが多数連なって形成されるポリUb鎖は様々な生体反応において重要なシグナルとして働き、その機能と構造についての知見は近年大きな進歩を遂げている。ポリUb鎖の形成に使われる残基は少なくとも8種類あり(Lys6, 11, 27, 29, 33, 48, 63及びMet1)、使われる残基によって異なるタンパク質機能制御様式をもつ(図1)。細胞のアポトーシスや分化・増殖に関わるJNK経路ではLys63結合型ポリUb鎖が、免疫・炎症反応の過程で刺激誘導される多くの遺伝子発現の発現誘導に関わるNF-κBシグナル伝達経路においては、Lys63結合型ポリUb鎖とMet1結合型ポリUb鎖が活性化のシグナルとして重要な役割を果たすことが知られている(図2)。
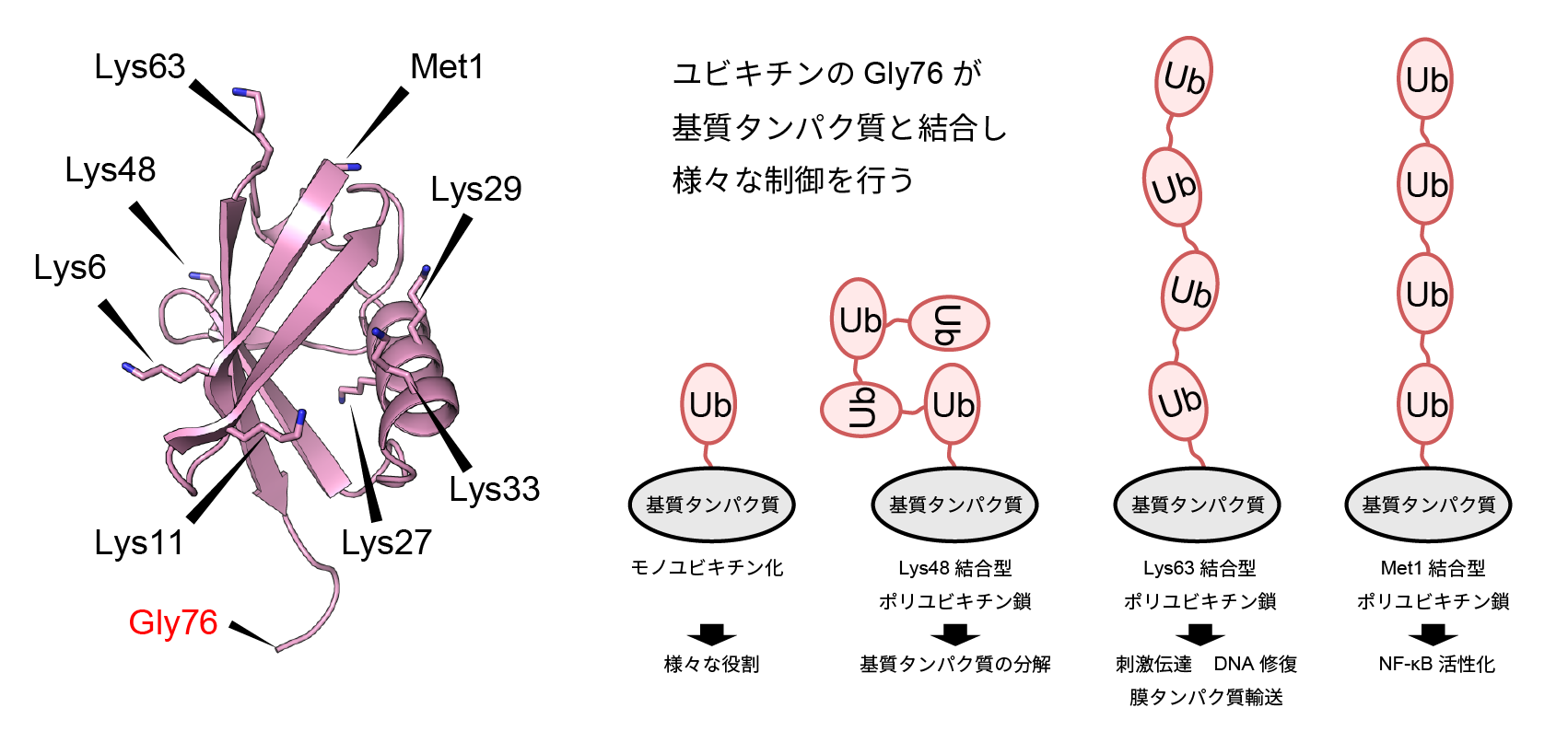
図1
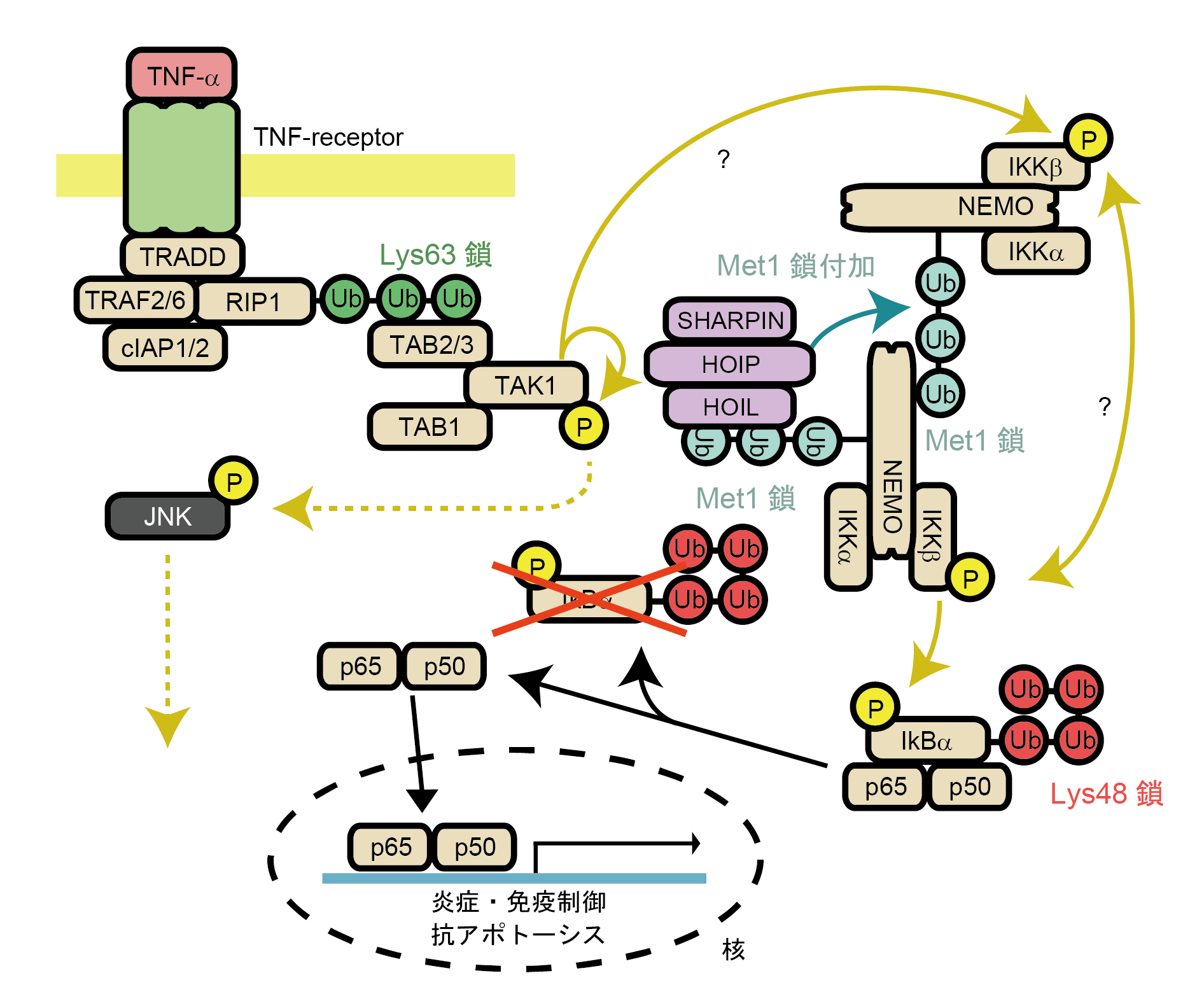
図2
CYLDはUSP(Ub specific protease)ファミリーに属する脱Ub化酵素で、家族性円柱腫症(常染色体優性遺伝による疾患で、円柱腫と呼ばれる良性腫瘍が主として頭皮に生じるもの)の原因遺伝子として同定された。特異性が無く、あらゆるUb鎖を切断するUSPが数多く存在する中、CYLDはLys63結合型、およびMet1結合型Ub鎖を特異的に切断する特徴的な性質を持ち、これによりシグナル伝達経路の過剰な活性化を阻害し、腫瘍や細胞の癌化を抑制する。
研究結果
本研究では数種類の生物のCYLDを比較した結果、最も結晶化に適していたゼブラフィッシュのCYLD USPドメイン(578-951アミノ酸残基の領域)を用いた。また、B-boxドメイン(781-849アミノ酸残基の領域)はCYLDの局在に関与するものの、CYLDの脱Ub化活性には関与しない領域であったため、削って結晶化を行なった。さらに、結晶中でCYLDがUb鎖を切断しないよう、切断反応に直接関わるCys596はセリン、もしくはアラニンに置換した。また、CYLDのGlu674はMet1結合型Ub鎖の切断効率を下げ、結晶中でも切断部位が活性中心へと接近するのを阻害するため、Met1-Ub2複合体に限り、グルタミンへと置換した。
上述の変異を導入したCYLDとMet1-Ub2複合体、CYLDとLys63-Ub2複合体をそれぞれ2.3 Å、3.1 Å分解能で決定した(図3)。どちらの複合体でも、CYLDは先端側Ubと近傍側Ubの形を同時に認識し、CYLDのCys596がポリUb鎖の切断部位に接近していた。先端側Ub、近傍側Ubとの相互作用はどちらも重要で、これらの相互作用残基に変異を導入するとCYLDの活性は減少することが確かめられた。つまり、CYLDの脱Ub化には、先端側Ubと近傍側Ubと同時に結合することが必要である。また、CYLDはMet1結合型ポリUb鎖やLys63結合型ポリUb鎖によって活性化されたJNKおよびNF-κBシグナル伝達経路を抑制するが、変異体を使った実験から、この抑制能はCYLDの脱Ub化能依存的であることが確かめられた。
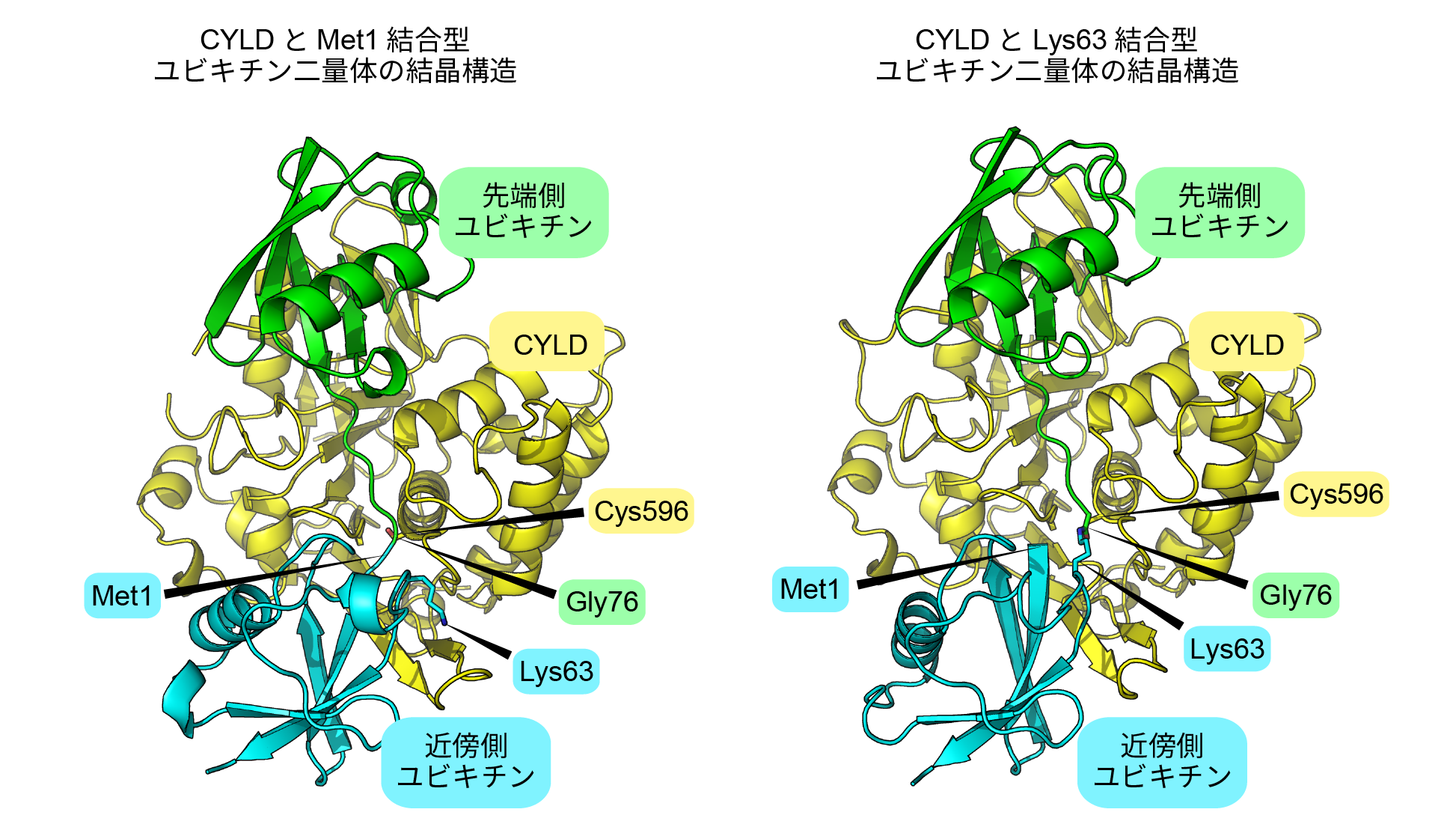
図3
続いて、Met1-Ub2複合体とLys63-Ub2複合体の比較を行なった。その結果、CYLDと先端側Ubは構造がよく一致するが、近傍側Ubは異なる配向をとることがわかった。では、CYLDは近傍側Ubの配向が違うにも関わらず、なぜMet-Ub2とLys63-Ub2のどちらとも相互作用できるのか?この理由の1つとしてCYLDとUb2の相互作用が柔軟である事があげられる(図4)。非常に興味深いことに近傍側Ubとの相互作用に関わるCYLDのβ9-β10シートは柔軟で、近傍側UbがMet1鎖とLys63鎖で配向が変わっても、違いに対応してCYLDのβ9-β10シートも動くため、β9-β10シートはMet1鎖、K63鎖のどちらでも近傍側Ubと相互作用できる。また、近傍側UbのGlu16もCYLDとの結合に重要であるが、こちらも近傍側Ubの配向の違いに対応して柔軟に動くことがわかった。また、詳細は割愛するが、いくつかの水素結合はMet1鎖とLys63鎖の間で切り替わり、どちらに対しても切断に必要なだけの親和性を得ているということが明らかとなった。
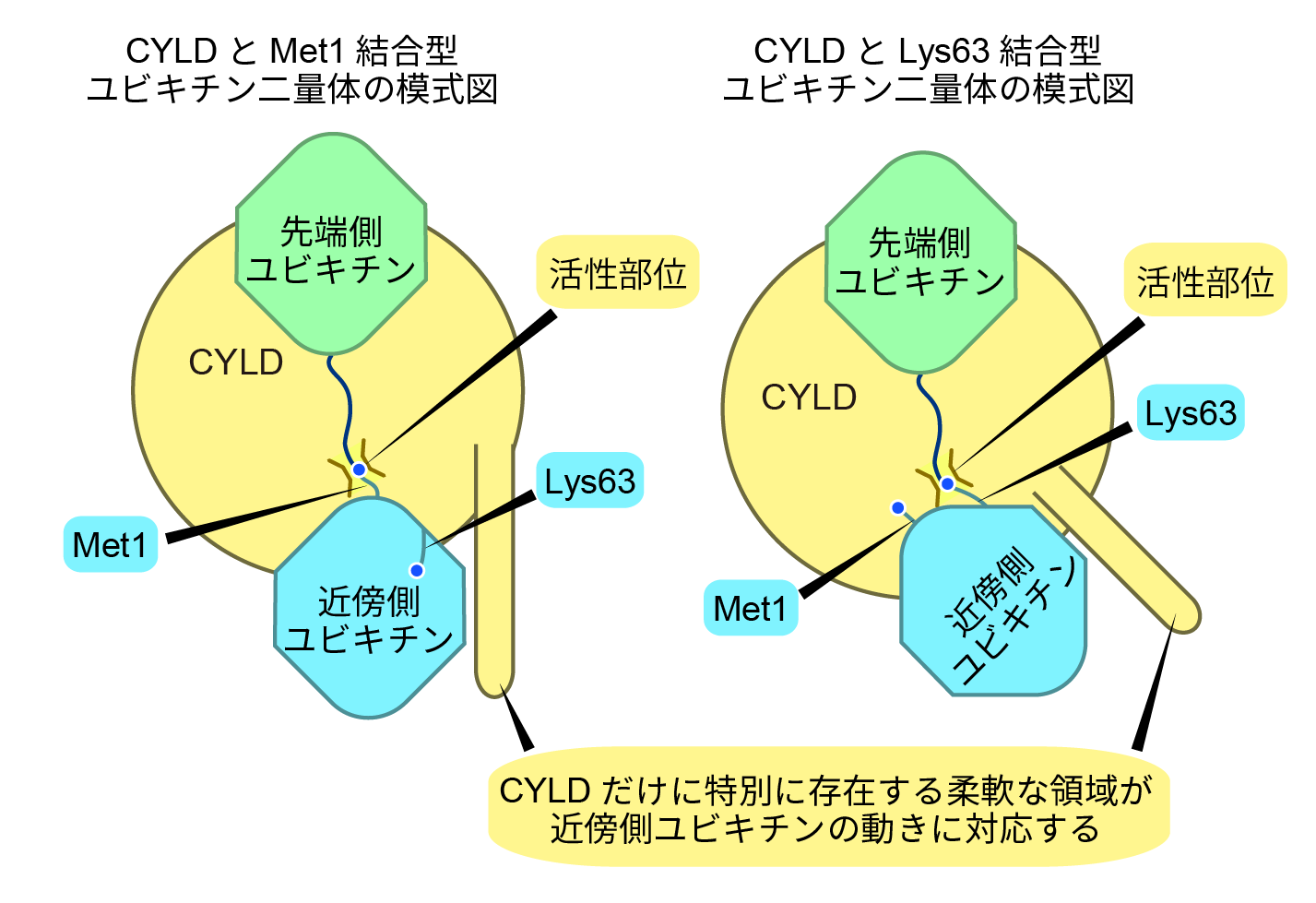
図4
最後に、CYLDと特異性の無いUSPの比較を行なった(図5)。CYLDはUSPファミリーに属するDUBであるが、Ub特異性の無い他のUSPと比べ、先端側Ubとの相互作用領域が欠失している一方、近傍側Ubとの相互作用領域(上述のβ9-β10シート)が挿入されている。Ub特異性の無いUSPは、先端側Ubとの相互作用のみで十分に結合するため、あらゆる種類のUb鎖を切断する事ができると考えられる。一方CYLDは欠失領域のため、先端側Ubとの相互作用のみでは不十分であり、近傍側Ubとの相互作用が必要である。この近傍側Ubとの相互作用を挿入領域によって強めるが、挿入領域を含む近傍側Ubとの相互作用領域がMet1鎖とLys63鎖に最適化されているため、CYLDはこれら2種のUb鎖に対して特異性を持つことが明らかとなった。
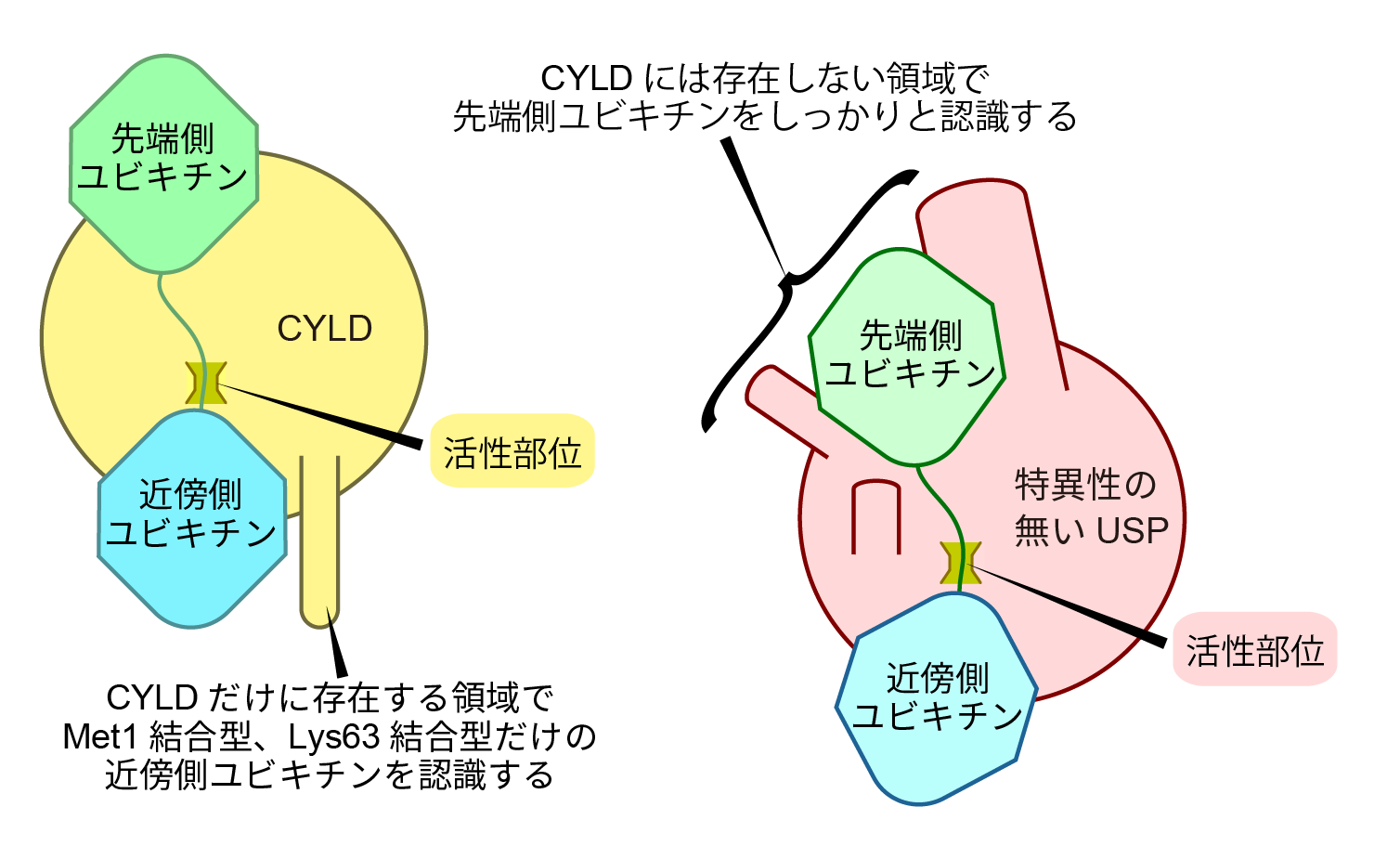
図5











