
Home > 研究成果 > Phos-tag SDS-PAGE systems for phosphorylation profiling of proteins with a wide range of molecular masses under neutral pH conditions.
研究成果
木下英司(広島大学・医歯薬)
Eiji Kinoshita, Emiko Kinoshita-Kikuta, and Tohru Koike
Phos-tag SDS-PAGE systems for phosphorylation profiling of proteins with a wide range of molecular masses under neutral pH conditions.
Proteomics, 11: 319-323, 2011 [PubMed] [Cover pictureに採用されました]
要約
Phos-tag SDS-PAGEは、同一タンパク質内のリン酸化状態の異なる複数のタンパク質フォームを泳動度の異なるバンドとして分離する新しい原理に基づく電気泳動法です。従来のMn2+–Phos-tag SDS-PAGEに改良を加え、亜鉛錯体としてのPhos-tagを中性条件下で行うBis-Tris–HClゲルやTris–AcOHゲルのSDS-PAGEシステムに適用することによって、今までに分離・検出が不可能であったタンパク質のリン酸化について解析することが可能になりました。解析できるタンパク質の数は飛躍的に増加し、研究対象のタンパク質の多くをカバーできます。また、Zn2+–Phos-tag SDS-PAGEではタンパク質のリン酸化状態(複数のリン酸化フォーム)を優れた分離能力によって一つ一つゲル上で分析することができます。そうして得られた泳動像は、リン酸化状態の存在比率や、その変化を可視化させ、特定のタンパク質で起こっているリン酸化反応を全体的に捉えることができるものです。さらには、2D-DIGEへの応用により、細胞内タンパク質群のリン酸化フォームに関する詳細な網羅的分析も益々発展することが予想されます。このような他に類のない特徴を持つPhos-tag SDS-PAGEを用いて、今後、多くの生体内のタンパク質のキナーゼ/ホスファターゼ依存的なダイナミクスがより詳細に解析されることを期待しています。
詳細
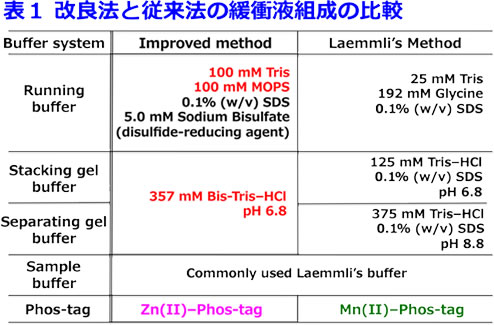
1) Bis-Tris–HClをゲルバッファーとしたZn2+–Phos-tag SDS-PAGE
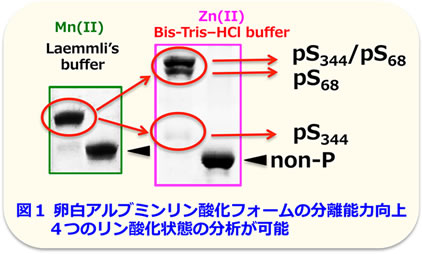
Mn2+–Phos-tag SDS-PAGEは、一般的なLaemmliのSDS-PAGE法を適用しており、簡便ではあるが、いくつかのタンパク質において、そのリン酸化フォームと非リン酸化フォームを分離することができない事例があった。Mn2+–Phos-tag SDS-PAGEでは泳動中のゲル内pHが9以上となるのに対して、中性Bis-TrisゲルのSDS-PAGE系を用いるZn2+–Phos-tag SDS-PAGEはPhos-tagが最も高いリン酸基捕捉能を示す中性pHでの泳動が可能であり、その分離能力が飛躍的に改善した。表1にBis-Trisバッファー系と従来のLaemmliバッファー系の組成をまとめ、図1にその実施例として卵白アルブミンをサンプルとした分離能の比較を示した。
2) Tris–AcOHをゲルバッファーとしたZn2+–Phos-tag SDS-PAGE
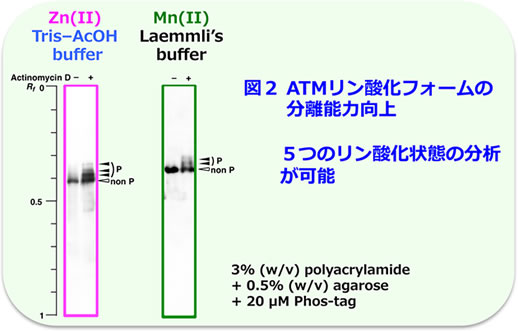
一般に200 kDa以上の高分子量タンパク質をSDS-PAGEで分離する場合は、4%(w/v)以下の低濃度のポリアクリルアミドゲルや、2%(w/v)を最低濃度とする濃度勾配ゲルを用いる。しかしながら、Bis-Tris–HCl をゲルバッファーに用いた中性pHのZn2+–Phos-tag SDS-PAGEでは、そのような低濃度のポリアクリルアミドゲルを作成することができず、200 kDa以上の高分子量タンパク質のリン酸化解析は不可能である。なぜなら、三級アミンであるBis-Trisは、TEMEDと過硫酸アンモニウムによるアクリルアミドモノマーの重合反応の際に、TEMEDと同様にラジカル種となり、アクリルアミドの重合反応に対してラジカルクエンチャーとしての機能を示すからである。よって、4%(w/v)以下の低濃度アクリルアミドを重合させようとする場合、その影響が特に大きくなり、十分な分子篩い効果を持つゲルを作成することはできない。そこで、三級アミン以外の中性pHのゲルバッファーであるTris–AcOHを用いたSDS-PAGEシステムを適用することによって、高分子量タンパク質のリン酸化解析に利用できるZn2+–Phos-tag SDS-PAGEを開発した。表2にTris–AcOHバッファー系の組成をまとめ、図2にDNA 損傷刺激に伴う HeLa 細胞内の毛細血管拡張性運動失調症の原因遺伝子産物であるATM(350 kDa)のリン酸化状態の変化を解析した例を示した。

3) 2-D DIGEと組み合わせた細胞内タンパク質のリン酸化状態の差異解析
疾患プロテオミクスにおいて、検体間の翻訳後修飾の違いを見分ける手法として、二次元蛍光ディファレンシャル法(2D-DIGE)は非常に有用である。一次元目に通常のSDS-PAGE、二次元目にZn2+–Phos-tag SDS-PAGEを用いた2D-DIGEによって、2つの検体間のリン酸化状態の差異を解析した例を示した。また、この実験例では、200 kDa以下のできるだけ多くのタンパク質におけるBis-Tris–HCl系とTris–AcOH系での分離能力についての比較も行った。二次元目の泳動像は、ゲル平面に対して対角線状のスポットの配置となるが、複数のリン酸化状態が存在するタンパク質については、その対角線からシフトアップしたスポットが検出される。リン酸化状態の差異が顕著な二つの検体として、Ser/Thrホスファターゼ阻害剤であるCalyculin Aを処理したもの, あるいは未処理のHeLa細胞のタンパク質抽出溶液を調製した。GEヘルスケア社のCyDye DIGE Fluor, minimal labelling kitを用いてCalyculin A処理試料はCy5標識、未処理の試料はCy3標識し、両者を混合して2D-DIGEにアプライした(図3)。Cy5とCy3をスキャンして得られた画像はそれぞれ緑とピンクであらわし、両者を重ね合わせたとき、重なるスポットを白であらわしている.図3の上段はBis-Tris–HCl系、下段はTris–AcOH系で泳動した結果である。Bis-Tris–HCl系では緑あるいはピンクのスポットが多く検出され、Calyculin A処理の有無による両検体のリン酸化状態の違いが明らかとなった。一方、Tris–AcOH系では白いスポットが多く、それらの分離度も小さく狭い範囲に密集している。このことから、200 kDa 以下の多くのタンパク質において、Bis-Tris–HCl系のZn2+–Phos-tag SDS-PAGEの方がより詳細なリン酸化状態を解析できると考えられる。しかしながら、Tris–AcOH系では、200 kDa以上のタンパク質のリン酸化解析においてBis-Tris–HCl系よりも優位であることは、上記した理由より明白である。

本研究では、2D-DIGEに加えてさらに、200 kDa以下のタンパク質解析におけるBis-Tris–HCl系と Tris–AcOH系ゲルバッファーの特性の違いを、EGFシグナリング下のERK(44/42 kDa)をサンプル(A431細胞)として詳細に調べた。両者の系において、MEK依存的な3つのリン酸化フォームを検出し、それぞれの部位特異的なリン酸化抗体と阻害剤を用いた実験により、1つは活性型のジリン酸化フォーム、残りの2つはその不活性化(脱リン酸化)過程から生じたモノリン酸化フォームであることがわかった。ただし、両者の系でそれぞれのリン酸化フォームの泳動パターンが異なることも明らかとなった。二つのゲルバッファー系において、ERKのリン酸化部位と泳動度の関係が一致しないことは、Zn2+–Phos-tagとリン酸化タンパク質の親和がゲルpH以外の要因(バッファーの種類、leading ion やtrailing ion等)の影響を受けることを示唆している。
このように、本法を用いることで連続的に進行するキナーゼ/ホスファターゼの反応を一枚のゲルで詳細に分析することもでき、従来法では解析不可能であった未知のリン酸化シグナルネットワークとそれに連結した生理・病理現象に関する知見を格段に広め深めることが期待できる。











