Home > 研究成果 > Specific recognition of linear ubiquitin chains by the Npl4 zinc finger (NZF) domain of the HOIL-1L subunit of the linear ubiquitin chain assembly complex
研究成果
佐藤裕介(東大・構造生物)
Yusuke Sato, Hiroaki Fujita, Azusa Yoshikawa, Masami Yamashita, Atsushi Yamagata, Stephen E. Kaiser, Kazuhiro Iwai, Shuya Fukai
Specific recognition of linear ubiquitin chains by the Npl4 zinc finger (NZF) domain of the HOIL-1L subunit of the linear ubiquitin chain assembly complex
PNAS. 2011 Dec 20;108(51):20520-5. Epub 2011 Dec 2. [PubMed]
要約
HOIL-1LとHOIPからなるリガーゼ複合体LUBAC(linear ubiquitin chain assembly complex)は、ユビキチンがN末端を介して結合した直鎖状ポリユビキチン鎖を合成する。生体内でLUBACはTNF-αなどの炎症性サイトカイン刺激により、IKK複合体のサブユニットであるNEMOに直鎖状ポリユビキチン鎖を付加することで、古典的NF-κBシグナル伝達系を活性化する。本研究では、HOIL-1LのNpl4 zinc finger(NZF)ドメインが直鎖状ユビキチン鎖と特異的に結合することを明らかにし、さらにHOIL-1LのNZFドメインと直鎖状ユビキチン2量体の複合体の結晶構造を1.7 Å分解能で決定した。また、結晶構造情報をもとにした変異体解析の結果から、HOIL-1Lによる直鎖状ユビキチン鎖の認識がNF-κBシグナル伝達経路において重要な役割を果たすことが明らかとなった。
詳細
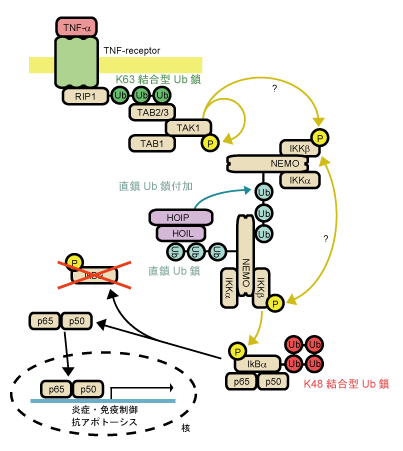
ユビキチン(Ub)が多数連なって形成されるポリUb鎖は様々な生体反応において重要なシグナルとして働き、その機能と構造についての知見は近年大きな進歩を遂げている。ポリUb鎖の形成に使われる残基は少なくとも8種類あり(Lys6, 11, 27, 29, 33, 48, 63及びMet1)、使われる残基によって異なるタンパク質機能制御様式をもつ。免疫・炎症反応の過程で刺激誘導される多くの遺伝子発現の発現誘導に関わるNF-κBシグナル伝達経路においては、Lys63結合型ポリUb鎖と、N末端メチオニン残基を用いて結合した直鎖型ポリUb鎖が活性化のシグナルとして重要な役割を果たすことが明らかとなっている(図1)。
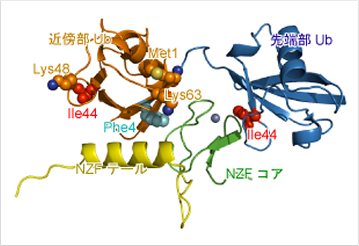
直鎖Ubの合成を行う複合体(LUBAC)は、NF-κBシグナル経路の活性化において重要な役割を担う。LUBACのHOIL-1Lサブユニットが直鎖Ubと結合することはすでに示されていたが、その構造的・機能的な解析は行われていなかった。本研究において、我々は、HOIL-1LのNpl4 zinc finger(NZF)ドメインが直鎖Ubに特異的に結合することを見出し、HOIL-1LのNZFドメインと直鎖Ub2量体との複合体の結晶構造を1.7 Å分解能で決定した(図2)。HOIL-1LのNZFドメインは,亜鉛イオンを配位した「NZFコア」領域とそれに付随するヘリカルな「NZFテール」から構成される。NZFコアは,先端部UbのIle44を中心とする疎水領域と近傍部UbのPhe4を中心とする疎水領域の両者と結合する。NZFテールは、近傍部Ubと相互作用して結合親和性を高めている。HOL-1LはUb間のリンク(Gly76-Met1結合)の直接的な認識は行なっていないが、近傍側UbのLys48およびLys63のアミノ基は先端側UbのGly76から離れており、Met1アミノ基のみが安定に結合できる距離にある。このため直鎖状Ub鎖のみ、2つのUbが同時にHOIL-1Lと結合できる。NZFとUbの結合は弱く、Ub単独では不十分であり、安定な複合体形成には2つのUbが同時に結合する必要がある。従って、同時に2つのUbが結合できる直鎖状Ub鎖のみが特異的にHOIL-1Lに結合する。これらの認識メカニズムをin vitroおよびin vivoでの変異体解析によって裏付けた。