Home > 研究成果 > Girdin is an intrinsic regulator of neuroblast chain migration in the rostral migratory stream of the postnatal brain.
研究成果
高橋雅英(名大・院医・分子病理)
Wang, Y., Kaneko, N., Asai, N., Enomoto, A., Isotani-Sakakibara, M., Kato, T., Asai, M., Murakumo, Y., Ota, H., Hikita, T., Namba, T., Kuroda, K., Kaibuchi, K., Ming, G., Song, H., Sawamoto, K. and Takahashi, M.
Girdin is an intrinsic regulator of neuroblast chain migration in the rostral migratory stream of the postnatal brain.
J. Neurosci. 31: 8109-8122 (2011). [PubMed]
要約
発生期のみならず生後・成体の脳においても、嗅球の介在神経細胞は前脳の脳室下帯で産生され続けていることが知られています。ここで新しく生まれた神経芽細胞はrostral migratory stream(RMS:吻側移動経路)と呼ばれる場所を通って嗅球に移動します。RMSでは神経芽細胞が「chain migration」と呼ばれる集団移動の様式をとることが知られていますが、その詳しいメカニズムはわかっていません。今回、私達はアクチン結合分子Girdinがchain migrationの重要な制御因子であることを明らかにしました。Girdinは以前Aktキナーゼの基質として同定された分子で、統合失調症の脆弱性因子の一つとして知られているDISC1(Disrupted-In-Schizophrenia 1)の結合分子でもあります。Girdinの変異体マウスを作製したところ、chain migrationの制御に重要なGirdinのアミノ酸領域が明らかになりました。脳室下帯で生まれた神経細胞は、脳梗塞などで神経細胞が失われた領域にも移動していくことが知られており、本研究は神経組織の修復や再生のための治療法の開発に寄与できる可能性があります。
詳細
以前は、神経細胞は成体(大人)の脳において新しく産生されることはないと考えられていたが、現在では脳の(1)海馬歯状回と(2)脳室下帯と呼ばれる領域では生後および成体になっても神経細胞が産生され続けていることが明らかにされている。本現象は「成体脳における神経新生(adult neurogenesis)」と呼ばれ、再生医療という観点からも近年、国内外の多くの研究者により注目されている。私達の研究室で以前同定されたアクチン細胞骨格結合分子Girdinのノックアウトマウスを作成したところ、生後に完成するとされる海馬歯状回の発生が顕著に障害されていることが明らかとなった。またGirdinは統合失調症の脆弱性因子の一つとして知られているDisrupted-In-Schizophrenia 1(DISC1)と結合し、両分子間の結合が新生した神経細胞の移動や適切な位置決定に重要であることが判明した(Neuron, 63:774-787, 2009)。私達の研究はGirdin/DISC1分子複合体が海馬歯状回の生後発生に重要であることを示すものであったが、他の研究グループにより全く同様のメカニズムが成体マウスにおける海馬歯状回のadult neurogenesisでも重要な役割を有していることが明らかとなった(Neuron<, 63:761-773, 2009)。
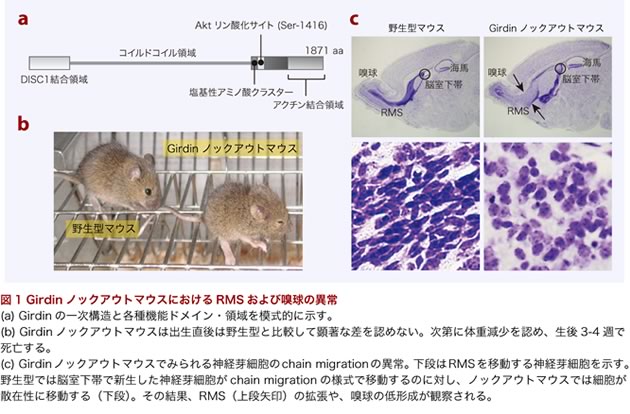
今回の研究ではadult neurogenesisが観察されるもう一つの場所である脳室下帯におけるGirdinの機能について検討している。脳室周囲に存在する脳室下帯で新生した神経細胞は長いRMS経路を移動して、嗅球にたどりついた後に介在神経細胞に分化し、新旧の神経細胞の入れ替わりに寄与することが知られている(図1)。野生型(正常)のマウスではRMSを移動する神経芽細胞はある程度の細胞間接着を維持しつつ、お互いを足場にして滑るように移動するchain migrationの様式をとるが、Girdinノックアウトマウスにおける神経芽細胞を観察したところ、各細胞が個々ばらばらに移動していることが明らかとなった。この結果、RMS経路の拡張と、それに伴う嗅球の低形成が観察された(図1)。
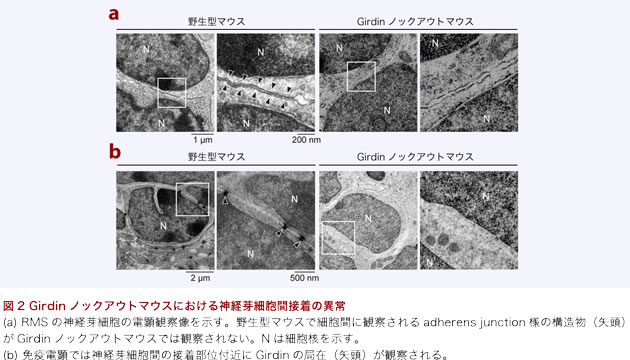
Girdinがどのような機序で神経芽細胞のchain migrationを制御するのか検討するため、Girdinのアミノ酸配列中で重要と推定される2カ所の領域にアミノ酸置換を加えた変異体ノックインマウスを作製した。GirdinのC末端ドメインに位置する塩基性アミノ酸クラスターをアラニンに置換したマウスでは、ノックアウトマウスとほぼ同様の表現系を示すことが明らかとなった。この塩基性アミノ酸クラスターの機能は明らかでないが、Girdinが細胞の形質膜や限界膜と相互作用すると推定されている領域であり、Girdinを介した細胞内膜輸送や形質膜のダイナミクスが神経芽細胞の運動を制御している可能性を示唆するものである。電顕でGirdinの局在を検討したところ、細胞間のadherens junction(接着結合帯)様の接着部位に観察されることから、細胞間接着の制御にGirdinが関わっている可能性が示唆された(図2)。
また私達はAktキナーゼによるGirdinのリン酸化が血管内皮細胞や不死化線維芽細胞の運動能を制御することを以前報告している。今回の研究では、リン酸化部位(1417番目のセリン)をアラニンに置換した変異体マウスも作製した。しかしながら、本マウスでは神経芽細胞の移動や嗅球の形成に明らかな異常を認めず、AktによるGirdinのリン酸化は少なくとも神経系では明らかな形態学的異常に結びつかないことが明らかとなった。
海馬歯状回および脳室下帯における神経新生を制御する分子は多数同定されている。しかしながらそれらの多くは神経組織特異的な遺伝子ノックアウトマウスの解析やRNA干渉法を用いた実験に依るところが多く、本当に神経新生に特異的な分子メカニズムはほとんどわかっていない。そのような状況の中で、Girdinはより特異的な神経新生の制御分子であることを明らかにした。脳室下帯で新生した神経細胞は、脳梗塞などにより神経細胞が脱落した部位にも移動していくことが最近の研究で明らかにされている。GirdinおよびGirdin/DISC1分子複合体は神経芽細胞の移動の重要な制御因子であり、本研究は神経再生医療の新たな戦略への端緒となる可能性がある。