
Home > トピックス・イベント > 中高校生・専門外の皆さんへの研究成果報告 > 井上純一郎
細胞は指令に忠実!だから健康!
 井上純一郎
井上純一郎
東京大学 医科学研究所 分子発癌分野
1955年 東京都生まれ
出身高校:千葉県立千葉高等学校
趣味:音楽(古いロック)、フットサル、飼犬(雑種♀)と遊ぶこと
研究室HP: http://www.traf6.com
細胞の中で指令が伝達されている。
人はたった一つの受精卵から卵割を繰り返し10か月余りの後誕生しますが、新生児の細胞数は約3兆です。成人ではさらに増えて60兆に達します。3兆というのは巨大な数ですが242が約4兆であることを考えると妊娠期間に平均して週に一度分裂する程度の速さと考えられます。ただ、ここで大事なことは受精卵がただ42回分裂しても単なる細胞の塊(かたまり)になるだけで人という生命体にはなりません。分裂しながら手足を作ったり、脳を作ったり、胃を作ったり、骨格を作ったりしなければなりません。そのためには細胞は単に増えること(増殖)に加えて、新たな機能を持つ別の細胞に変化したり(分化)、機能すべき位置に移動したり(運動)、自ら消滅したり(細胞死あるいはアポトーシス)する必要があります(図1)。このような作業を計画的に実行するために細胞はその細胞の外から来る指令(増殖、分化等を細胞に促す命令)を受容体というセンサーで感知し、その指令を細胞内へ伝達させます。さらに細胞内でその指令が複数のシグナル伝達因子(主にタンパク質)間をリレー式に伝わっていき、最終的には転写因子(特定の遺伝子のmRNAの発現を誘導したり逆に抑制したりするタンパク質)の機能をコントロールすることで遺伝子の発現パターンを変化させます。こうして細胞は細胞外から来た指令を実行します(図2)。このような細胞の中での指令の伝達を「細胞内シグナル伝達」と呼んでいます。正常な細胞内シグナル伝達は、上記のような胎児の形作りに必須であるとともに生後においても細菌やウイルス感染で誘起される炎症免疫反応、脳神経機能、損傷治癒等において必須な役割を果たします。
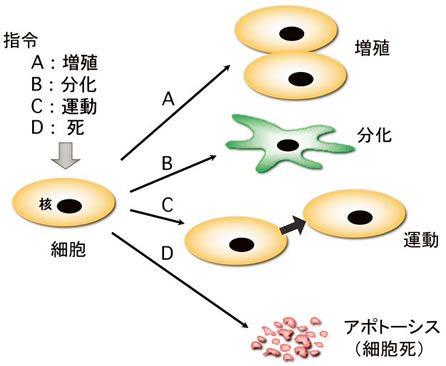
図1 細胞にA増殖、B分化、C運動、D細胞死の各指令が与えられた時の細胞の対応の仕方
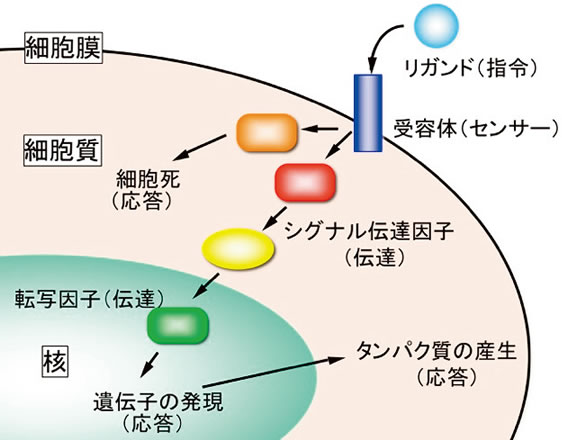
図2 指令が細胞に感知されその指令が細胞内を伝達される(細胞内シグナル伝達)様子
エヌ・エフ・カッパー・ビー(NF-κB)って何?
私が研究対象としているタンパク質は、核内で遺伝子の発現に関わる転写因子でエヌ・エフ・カッパー・ビー(NF-κB)と言います。NFはNuclear Factorの略で核内で働くタンパク質という意味です。κは抗体(免疫グロブリン)の構成タンパク質であるκ軽鎖、Bは抗体を作るB細胞を意味します。総合すると「B細胞が抗体のκ軽鎖遺伝子を発現誘導する際に機能する転写因子」という意味です。これは30年ほど前にNF-κBが発見された当初の命名です。その後の研究でNF-κBはほぼすべての細胞に存在し、抗体遺伝子以外にも細胞の増殖、分化に関わる遺伝子や細胞死を制御する遺伝子の発現に関わっていることがわかっています。さらにこれまでの研究でNF-κBが休止状態から活性化する仕組みが明らかになってきました。タンパク質の中には、常に機能を発揮する必要がないものや、常に機能を発揮すると細胞や体に害があるものがあります。NF-κBは後者にあたります。ですので、NF-κBは本来核に行って転写を誘起するものですが、普段はIκBα(アイ・カッパー・ビー・アルファー、Inhibitor of NF-κB α, NF-κBの阻害タンパク質α)と呼ばれる別のタンパク質に妨害されて核に移れず細胞質に留まっています(図3)。すなわち、普段は機能を発揮できない状態になっています。皆さんの体のほとんどの細胞ではこの状態になっています。細菌感染等で細胞の外からNF-κB活性化を命令する指令が来てそれを受容体(センサー)が感知する(図3①)とその指令が受容体の近くの細胞質のタンパク質に伝達されます。その数段階の指令伝達の結果、IκBαの中のセリンというアミノ酸の側鎖の水酸基(-OH)にリン酸が付加されます(図3②)。次にこのリン酸の付加が原因でIκBαのリジンというアミノ酸の側鎖のアミノ基(-NH2)にユビキチンという76アミノ酸から成るペプチドが鎖状に多数付加されます(図3③)。このようにタンパク質の翻訳が完了した後にリン酸やユビキチンのような分子が付加することを「翻訳後修飾」と言い、リン酸が付加することをリン酸化、ユビキチンが付加することをユビキチン化と言います。重要なことに、このような翻訳後修飾はタンパク質の機能を変化させたりタンパク質のその後の運命が決めるのです。例えばIκBαの場合、ユビキチン化されるとプロテアソームというタンパク質分解を担うタンパク質複合体に基質として認識され急速に分解されて消失します(図3④)。その結果、NF-κBはIκBαによる縛りから解放され核に移行することになります(図3⑤)。核に移行したNF-κBは自身が標的とする遺伝子の発現を誘導し(NF-κBはGGGACTTTCCまたはそれに類似のDNA配列に結合します。したがってこの配列を発現制御配列に持つ遺伝子はNF-κBによって発現誘導されます。(図3⑥))、細胞は増殖したり分化したりして炎症免疫反応等の高次な生命現象を引き起こします。ユビキチン化は「ユビキチンが多数鎖状につながって付加されること」と書きましたが、実は鎖のつながり方に幾つかの型があり、型によってユビキチン化されたタンパク質の運命や機能が異なってきます。例えば、プロテアソームによって分解されるためにはK48型鎖がタンパク質に付加される必要があります。一方、NF-κB活性化においてはK63型やM1型と言った鎖も活躍します。IκBαがK48型ユビキチン化されるためにはIκBのリン酸化が必要であることを述べましたが、そのリン酸化を起こすのがIκBキナーゼ(IKK)と呼ばれるタンパク質リン酸化酵素複合体でIKKα, IKKβ, NEMOという3種類のタンパク質で構成されます。IKKは通常不活性化状態ですが細胞外からの指令があると活性化されます。このIKKの活性化は指令依存的に合成されるK63型やM1型ユビキチン鎖が足場となってIKKを含む複数のタンパク質を集合させることで起こります。すなわちNF-κBを活性化する細胞内シグナル伝達は少なくとの3種類の鎖型のユビキチンの連携で稼働していることになります(図3)。
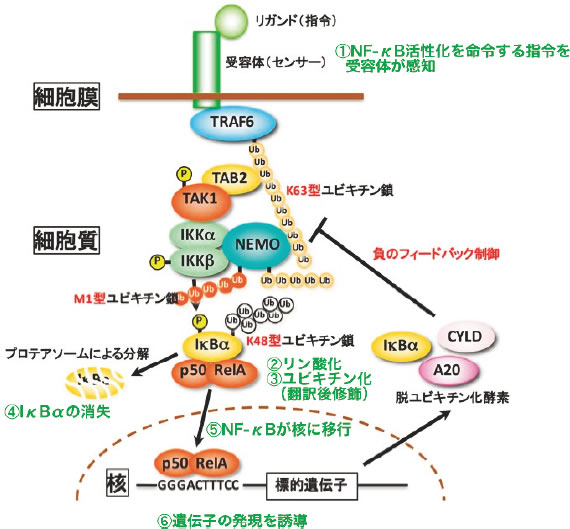
図3 NF-κB活性化シグナルが細胞内伝達される様子。NF-κBはp50とRelAの2量体として描かれている。
NF-κBは”健康”に必須、でも”がん”でも活躍する。
正常細胞では、前述のようにNF-κBは常時働いて欲しくないので、指令が来ない限り活性がなく細胞質に係留されています。指令が来ると活性化されるのですが、その活性化の強さや長さはいろいろな仕組みで適度に制限されていますし、正常細胞では指令が無くなれば元の状態(活性がなくNF-κBが細胞質に係留された状態)に戻ります(図4:正常な活性化)。どうやら、がん細胞ではこのようなNF-κBのコントロールが破綻してしまっていて、指令がないのにNF-κBが活性化してしまい、そのためにがん細胞ができたり、またできたがん細胞がさらに悪性化すると考えられています(図4:恒常的活性化)。また、NF-κBが標的とする遺伝子の中には、NF-κBの活性化に重要な役割を果たすK63型やM1型のユビキチン鎖を分解してNF-κB活性化を抑えるタンパク質(脱ユビキチン化酵素)を作るものがあります。このようにあるものが活性化したことでそれを抑える物質作ってその活性化を抑えて制限することを「負のフィードバック制御」(図3)と言いますが、これが何かの原因で機能しなくなると活性化の程度が亢進するとともに持続時間も延長されます。このような状態を過剰な活性化と言いますが、過剰なNF-κBの活性化は過剰な炎症反応を誘起し、がんを含むいろいろな病気の原因と成ります(図4:活性持続性の延長または最大活性の増大)。今までの説明でNF-κBの活性化メカニズムの詳細を明らかにすること、そしてその制御の破綻がどのように疾患に結びつくのかを解き明かすことが如何に重要かを分かっていただけたでしょうか?まだまだわからないことがたくさんあるのです。このような現状を鑑み私たちは研究をしています。
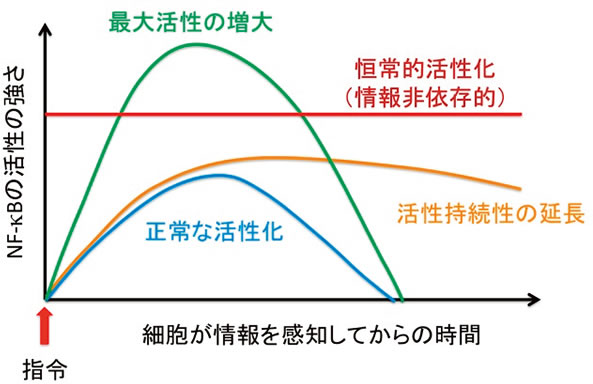
図4 正常なNF-κB活性化シグナルと疾患発症につながる異常なNF-κB活性化シグナル
5年間の研究で見つけたこと。
そこで私たちの研究グループは文部科学省に「翻訳後修飾によるNF-κB活性化シグナルの制御機構と疾患発症との関連」という題名で5年間の研究計画を申請し、厳しい審査の結果採択され研究費(科学研究費補助金:「科研費」と略して呼びます)をいただきました。その研究費を使用して以下に記す成果を上げることができました。これらはいずれも、がんやその他の疾患に関する原因解明を加えて治療薬や治療方法の開発に貢献すると考えています。
1. ヒト白血病ウイルスは世界的に見ると日本国内に感染者が多く、しかも感染した一部の人に重篤な白血病を発症させます。このウイルスによる白血病発症にはウイルスが作るTaxとHbzという二つのタンパク質が関与すると考えられています。そのうちのTaxはウイルスが感染した細胞のNF-κBを恒常的に活性化することで細胞に永久に生きて増える能力を与えると考えられています。私たちは試験管内でTaxによるNF-κB活性化を再現することに成功しTaxが細胞のタンパク質を利用して複数の鎖型のユビキチンを作ることでNF-κBを活性化することを明らかにしました。
2. 活性化IKK複合体を細胞から取り出しその複合体構成タンパク質を質量分析器で解析することでp47というタンパク質を見つけました。p47がNF-κB活性化指令によりK63型やM1型ユビキチン鎖が付加したNEMOに結合しNEMOをリソゾームに運搬し分解させることでNF-κBの活性化を負に制御することを明らかにしました。
3. がん幹細胞は腫瘍の中に少数存在する抗がん剤治療に抵抗性の細胞です。予後が悪く再発性の高い悪性の乳がんにおいて、このがん幹細胞がNF-κBによって維持されていることを明らかにしました。さらにその理由を研究したところ、がん幹細胞の周囲のがん幹細胞以外のがん細胞(非がん幹細胞)の中のNF-κBがNOTCHというセンサーの指令であるJAG1を発現誘導しそのJAG1がすぐ隣にいるがん幹細胞のNOTCHに指令を与えることであることを明らかにしました。
4. NF-κBの活性化には古典的経路と非古典的経路の2種類がありお互いに協調して機能しています。ユビキチン編集(修飾)酵素であるA20が古典的NF-κB経路により発現誘導され古典的経路を負に制御することはすでに報告されていましたが、私たちは発現誘導されたA20がcIAPに結合することで非古典的経路の活性化を誘導することを明らかにしました。
5. 悪性の乳がんにおけるNF-κBの恒常的活性化ががんの悪性化を招く原因を明らかにするためにNF-κBが発現誘導する標的遺伝子(図3)をNF-κBを人為的に抑制することで多数見つけました。その中の一つであるTropomodulin 1(TMOD1)は、β-Cateninという転写因子を安定化することでMMP13というがんの組織浸潤性を高める遺伝子の発現を促進することを明らかにしました。











