
Home > トピックス・イベント > 中高校生・専門外の皆さんへの研究成果報告 > 武川睦寛
細胞の情報(シグナル)伝達の理解から疾患の克服へ
 武川睦寛
武川睦寛
東京大学 医科学研究所 分子シグナル制御分野
1964年 東京都生まれ、札幌育ち
出身高校:北海道立札幌南高等学校
趣味:音楽鑑賞、ギター演奏
研究室HP: http://www.ims.u-tokyo.ac.jp/dcsmm/DCSMM/Top.html
「シグナル伝達」システムの代表「MAPキナーゼ経路」
細胞は外界からの様々な刺激を感知して、細胞内にシグナルを伝え、特定の遺伝子の発現量を調節することで外部環境の変化に適応しています。例えば、増殖因子が細胞表面にある受容体に結合すると、受容体から発せられたシグナルは、細胞質を通して核に伝えられ、細胞増殖に必要な遺伝子の発現が誘導されます。この場合、細胞表面からの情報が細胞内を通して核にまで伝わる過程がシグナル伝達です。シグナル伝達においては、情報を伝えるべき相手(分子)を選び、正しいタイミングで適切な強さのシグナルを伝える必要があります。この様なシグナル伝達の制御は、「リン酸化」などに代表されるタンパク質の翻訳後修飾によって担われています。
細胞内の情報伝達を担う仕組みの一つとして、MAPキナーゼ(MAPK)経路と呼ばれるシグナル伝達経路があります(図1)。MAPK経路は、MAPK、MAPKK、およびMAPKKKという3種類のタンパク質リン酸化酵素(タンパク質をリン酸化する作用を持つ酵素を、総称してキナーゼと呼びます)によって構成されるシグナル伝達システムです。増殖因子や、細胞外環境の様々な変化(温度、浸透圧、紫外線や放射線照射など)によって生じたシグナルは、このMAPキナーゼ経路をMAPKKK−MAPKK− MAPKの順に伝わって行き、最終的に様々な遺伝子の発現量を変化させたり、別のタンパク質の機能を変化させたりします。このことによって細胞の増殖、分化、死などが適切に制御されています。この様にMAPキナーゼ経路は、細胞内情報伝達の根幹をなすシステムであり、細胞の運命を決定づける働きをしています。これまでにMAPキナーゼ経路の情報伝達には、翻訳後修飾の一種であるタンパク質のリン酸化が重要であることが明らかにされて来ました。即ち、MAPKKKがMAPKKをリン酸化して活性化し、さらに活性化されたMAPKKがMAPKをリン酸化して活性化するのです。また、活性化されたMAPKは、その一部が核内に移行して様々な転写因子をリン酸化し、その転写能を変化させて多彩な遺伝子の発現を調節します。即ち、リン酸化は、蛋白質の機能を制御するスイッチとして働いています。
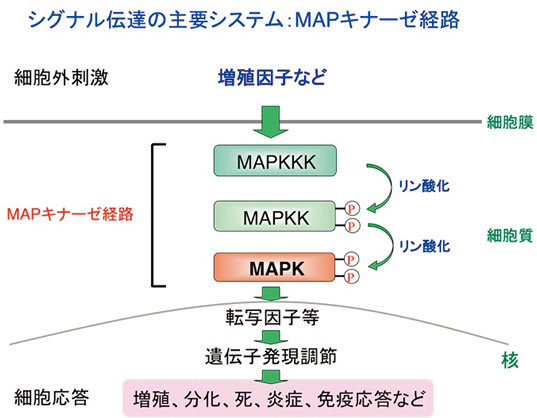
図1: MAPキナーゼ経路は3種類のリン酸化酵素で構成されている
ヒトMAPキナーゼ経路と疾患
MAPキナーゼ経路は、酵母からヒトに至るすべての真核細胞に共通して存在するシグナル伝達システムですが、ヒトの細胞内には、機能の異なる少なくとも3種類のMAPキナーゼ経路(ERK経路、p38経路、JNK経路)が存在することが知られています(図2)。
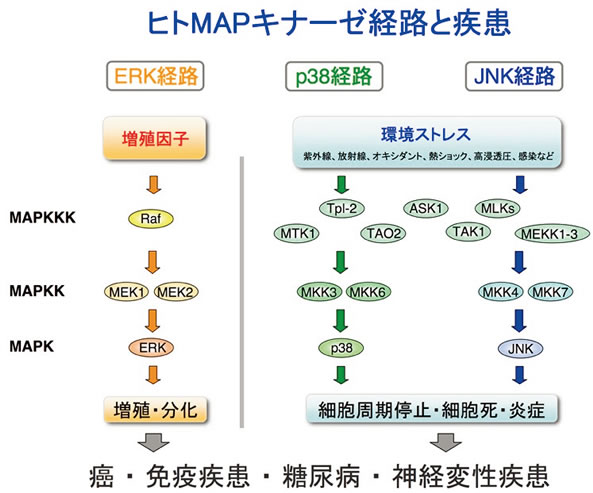
図2:3種類のヒトMAPキナーゼ経路
・ERK経路:
主に増殖因子によって活性化され、細胞増殖や分化を制御しています。ERK経路を活性化する機能を持つ増殖因子受容体や、Rasなどの分子は癌遺伝子であることが知られており、これらの遺伝子の変異によってERK経路が異常に活性化すると細胞が癌化することが知られています。
・p38およびJNK経路:
ストレス応答MAPキナーゼ経路とも呼ばれています。紫外線や放射線、オキシダント、熱ショック、高浸透圧など、様々な環境ストレス刺激によって活性化されて、ストレスを被った細胞に死を誘導します。また、ウイルスなどの病原体の感染によっても強く活性化されて、炎症や免疫応答の調節に中心的な役割を果たしています。
これら複数のMAPキナーゼ経路が正しく制御されることで、人体は健康な状態でいられますが、MAPキナーゼ経路に何らかの異常が起こってしまうと、癌、アレルギー・自己免疫疾患、糖尿病や神経変性疾患などの病気になってしまうことが知られています。従って、MAPキナーゼ経路の活性を調節する薬剤は、癌や関節リウマチなどに対する新たな治療薬となる可能性があり、実際に多くの製薬企業によってMAPキナーゼ経路をターゲットとした薬剤(活性阻害薬など)が開発され、現在、臨床試験が行われています。本学術領域研究において、私達は、MAPキナーゼ経路の活性制御メカニズムと生理機能、および疾病との関連を、特に翻訳後修飾の観点から分子レベルで解き明かし、難病の治療に役立てることを最終的な目標として、研究を行って来ました。その結果、MAPキナーゼ経路の活性制御にSUMO化などの新たな翻訳後修飾が関与することを見出すと共に、この経路の制御に関わる複数の新規分子を同定することに成功しました。さらに、MAPキナーゼ経路の制御異常と疾病(癌や神経変性疾患など)との関わりを明らかにしました。
1)SUMO化によるERK経路の活性制御と癌におけるその破綻
上述のように、ERKはリン酸化されることでキナーゼ活性が“ON”になりますが、このリン酸化を担うキナーゼが“MEK”です。本研究で私達は、MEKが、SUMOと呼ばれる小さなタンパク質に結合するとキナーゼ活性がoffになり、細胞増殖と癌化が抑制されることを見出しました。さらに、癌細胞では、変異したRasというタンパク質がMEKからSUMOを取り去ることで、MEKのキナーゼ活性を亢進させて、ERK経路を強力に活性化し、癌化を促進していることを見出しました(Nat. Cell Biol., 2011)。
2)ERKによってリン酸化される新規タンパク質MCRIP1の同定と、癌転移促進機構の解明
上述の様に、ERKの異常な活性化は、細胞を癌化させたり、癌の浸潤や転移を導くことが知られています。このメカニズムを解明するため、私達は、ERKによってリン酸化されるタンパク質の網羅的同定を行い、これまでに全く報告の無い新たな分子(MCRIP1と命名)を発見することに成功しました。更に、MCRIP1の生理機能の解析を行い、MCRIP1が、癌抑制遺伝子として知られるE-カドヘリンの発現制御に重要な役割を果たしていることを見出しました(図3)。E-カドヘリンは、皮膚や粘膜(腸管や気管などの表面)を構成する細胞(上皮細胞)に発現している分子であり、細胞同士を強固に繋ぎ止めることで細胞を動かない様にしている分子です。刺激の無い状態で、MCRIP1はE-カドヘリンの発現を維持する機能を持っていますが、増殖因子などによってERKが活性化すると、MCRIP1がリン酸化されてその機能を失い、E-カドヘリンの発現が消失することを見出しました。さらに、癌細胞内で強く活性化したERKが、MCRIP1を強くリン酸化することで、E-カドヘリンの合成が停止し、その結果、癌細胞が自由に移動できるようになり、周囲の組織に浸潤したり、遠隔転移したりすることを突き止めました(Mol. Cell, 2015)。
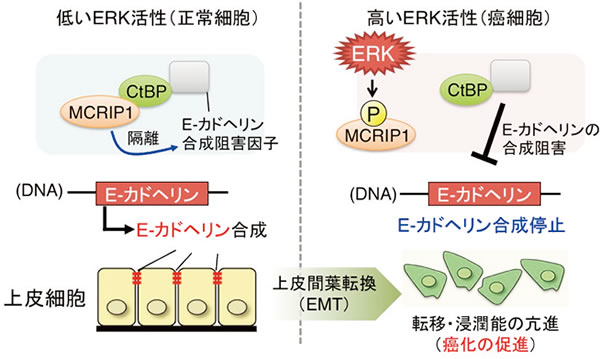
図3:ERKおよびMCRIP1によるがん転移の促進
3)ストレス応答MAPK(p38/JNK)経路による中心体複製制御
細胞は分裂する際に、遺伝情報を次世代へと正確に伝達するため、自身の染色体を2つの娘細胞に均等に分配しています。このプロセスには“中心体”という小さな細胞内構造物が関与することが知られています。中心体は通常、分裂期の細胞内に2つ存在していますが、その数が異常に増加すると染色体が均等に分配されず、癌化の引き金になることが明らかにされています。興味深い事に、癌細胞では、紫外線や放射線などの様々なストレス刺激に応答して、中心体の数が異常に増加することが報告されており、また中心体数の異常が染色体の異常を招いて癌が更に悪性化し、患者の寿命を縮めてしまうことも示されています。一方、正常な細胞では中心体数は厳密に制御されており、ストレス環境下でも中心体数の異常は起こりませんが、そのメカニズムに関してはこれまでほとんど分かっていませんでした。本研究で私達は、様々なストレス刺激に応答して活性化される2つの細胞内シグナル伝達経路、即ちストレス応答MAPキナーゼ(p38およびJNK)経路と p53経路が、協調して中心体複製の鍵分子であるPLK4の活性を調節しており、ストレス環境下で中心体数が異常に増加するのを防ぎ、発癌を抑制していることを見出しました(図4)。また、様々な癌細胞において、p53とストレス応答MAPキナーゼ経路が共に失活しており、その結果、中心体数が異常に増加して癌の悪性化が導かれていることを示しました(Nat. Commun., 2013)。

図4:MKK4とp53による中心体数の調節とその異常による細胞の癌化
4)ストレス顆粒(SG)の形成機構と疾患における形成異常の解明
細胞は生存を脅かす様々なストレス(異常タンパク質の蓄積、低酸素、ウイルス感染、熱ショックなど)を感知すると、その状況から回復する時間を確保するため、「ストレス顆粒(SG)」と呼ばれる構造体を形成して、タンパク質の合成を一時的に停止します。今回、私たちはストレス刺激に応答して形成されるSGのふるまいを数式で表現(数理モデル化)し、SG形成のメカニズムを詳細に解析しました。その結果、TIA1というタンパク質の集合と、その細胞内輸送がSG形成の基本原理であることを見出しました(PLoS Comp. Biol. 2015)。また、SGの形成異常と疾患との関連についても研究を行い、TIA1が活性酸素によって酸化されるとSG形成が妨げられることを発見し、さらにこのことが、神経変性疾患(アルツハイマー病など)で認められる神経細胞死の一因となることを見出しました(Nat. Commun., 2016)。
5)細胞内でMAPキナーゼ(ERK、p38、JNK)活性を可視化する手法の開発、および炎症応答に重要なp38活性化リズムの発見
細胞増殖を担うERK、そしてストレス応答を担うp38及びJNKは、外部刺激に応答して活性化され、様々なタンパク質をリン酸化することで、多彩な細胞機能を制御しています。しかしながらこれまで、各MAPキナーゼ分子が、細胞内のどの場所で、また、どのようなタイミングで活性化されているのか、その詳細な挙動を追うことは困難でした。私達は、これらのMAPキナーゼ分子の活性化を、生きた細胞内で可視化し追跡できる、画期的な観察システムを開発しました(Sci. Signal., 2012)。またこのシステムを用いて、実際にp38の活性化を観察したところ、炎症反応の際に起こるp38の活性化は規則的に“振動”しており、活性化と不活性化が周期的に繰り返されていることを見出しました。さらにこの振動現象が、炎症や免疫応答を増強する合図になっていることを明らかにしました(Nat. Commun., 2015)。











