
Home > トピックス・イベント > 中高校生・専門外の皆さんへの研究成果報告 > 石谷隆一郎
タンパク質の形から生命の謎を解く
 石谷隆一郎
石谷隆一郎
東京大学大学院 理学系研究科 生物化学専攻
1974年 兵庫県生まれ
出身高校:香川県立丸亀高等学校
趣味:料理,パン作り
研究室HP: http://www.nurekilab.net
我々人間の体は細胞からできており、細胞はさまざまな成分からできています。なかでも、タンパク質と酵素は多くの生命現象において重要な役割を果たしています。細胞の中で働くタンパク質は何万種類も存在しますが,タンパク質は、20種類のアミノ酸が数珠状につながったもので、どのアミノ酸がどのような順番でつなげられてタンパク質が作られるかは、生命の設計図であるゲノムによって決まっています。そしてタンパク質は、最終的には、その並びに応じて複雑に折り畳まり、それぞれに独自の形をとりますが,この独自の形(立体構造)は、タンパク質や酵素が働く(機能を発揮する)うえで非常に重要です。そのため、細胞の活動の鍵となるタンパク質の構造と機能を解明することは、生命のしくみを理解する上で非常に重要となっています.
特に、細胞の中のタンパク質は単独で働いているわけではなく、さまざまなタンパク質が相互に結合したり、離れたりすることで、様々な命令(シグナル)を伝え合うことで機能を発揮しています。また最近、タンパク質には、「目印」のようなもの(翻訳後修飾)がつけられ、この目印が、この命令の伝わり方などのタンパク質の機能が大きく変化させ、タンパク質が生命を支えていくうえで非常に重要であることが分かってきました(図1)。また、この目印には非常に多くの種類があり、さらに、目印は適当につけられているわけではなく、必要な時に、必要な場所にだけに、規則正しくつけられていることや,このような目印は必要に応じて取り除かれることも分かってきました.

図1:タンパク質の合成と翻訳後修飾
一方,多くの病気は細胞の活動の不調に由来しています。特に、先に説明した細胞の命令(シグナル)とタンパク質の目印(翻訳後修飾)に関係するものには、その働きの異常が、ガンなどの病気の原因となっている場合が多いことが分かってきました.例えば,目印をつける役割を持つ酵素が暴走し,不必要に目印をつけるようになってしまった場合や,目印を取り除く役割を持つ酵素が機能できなくなってしまった場合などに細胞のがん化が引き起こされることが知られています.これらのタンパク質の異常を正常にするような薬を作れば、病気の治療を行うことができるかもしれません。そのため、これらのタンパク質の構造と機能を調べることは、生命を理解するだけではなく、病気の治療などに役立てることができると期待されています。
このような命令の伝達する役割を持つタンパク質の形(立体構造)を詳しく調べれば、どのようにして命令がタンパク質の間で伝えられるのか、という謎が解けます。また、これらの謎を解き明かすには、タンパク質同士が相互に結合して、命令を伝えている瞬間をとらえることが必要です。したがって、本研究では、上述の目印がどのように命令の伝達に影響するのか、さらには、どのようにして目印自体がつけられているのかに注目して、タンパク質の立体構造を調べる研究を行いました。特に,著者らのグループではこのような目印(翻訳後修飾)の一種である「ユビキチン」というタンパク質に着目して研究を行いました。このユビキチン修飾を取り除く役割を持つ酵素(脱ユビキチン化酵素)の一つとしてA20という酵素が知られていますが,このA20がユビキチン修飾を取り除くだけではなく,直鎖状ポリユビキチンという特殊なタイプのユビキチンに結合することを明らかにしました.また,A20が直鎖状ポリユビキチンに結合することで,細胞内のシグナル伝達のうち,NF-κB(エヌエフカッパービー)と呼ばれる免疫反応に関わるシグナルを抑える役割を持つことを明らかにしました(図2).
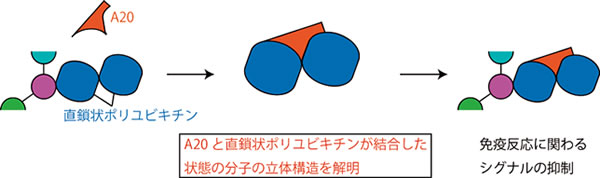
図2:A20と直鎖状ポリユビキチンの結合による免疫反応に関わるシグナル抑制のメカニズム
さらに,A20がどのようにして直鎖状ポリユビキチンに結合するかを解明するために,A20と直鎖状ポリユビキチンが結合した状態の分子の立体構造を調べる研究を行いました.一部のB細胞リンパ腫の患者さんの細胞では,このA20に変異が起こり,病気の原因となっている可能性が指摘されています.A20の変異が起こっている箇所は,A20とユビキチンが結合する際に,要となる部分に位置していることが,分子の立体構造を調べた結果から明らかになりました(図3).すなわち,一部のB細胞リンパ腫の患者さんの細胞では,変異によりA20のこの要の部分が壊されてユビキチンに結合できなくなり,最終的に免疫反応に関わるシグナルを抑えられなくなっている可能性があることが明らかになってきました.このような結果は,最終的にB細胞リンパ腫の治療法の開発へとつながるものです.
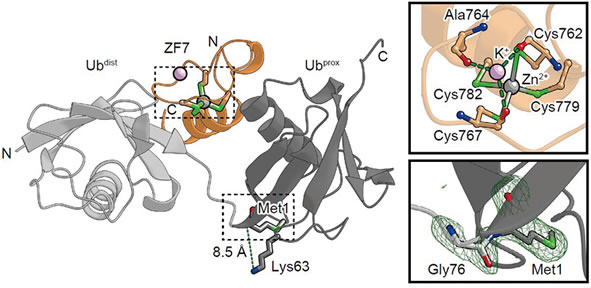
図3:A20 と直鎖状ポリユビキチンが結合した状態の分子の立体構造











