
転写振動を駆動する時計タンパク質の修飾シグナルとその破綻による行動リズム異常
 |
研究代表者 深田吉孝 東京大学 大学院理学系研究科 http://www.biochem.s.u-tokyo.ac.jp/fukada-lab/ |
【研究概要】
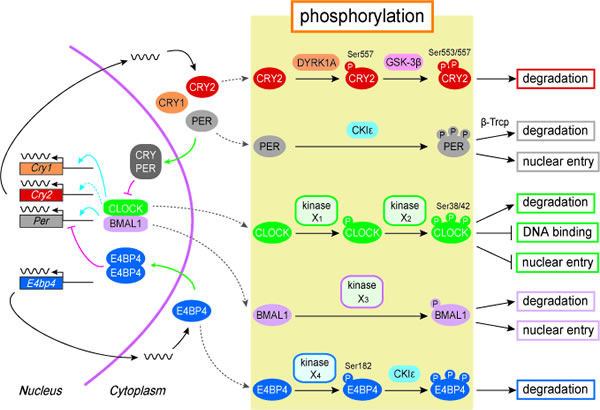
生物に普遍的な約1日周期のリズムを生み出す概日時計は、さまざまな細胞の基本的機能に共役することから、近年、生命科学の多くの研究分野において注目されている。この概日時計の振動には、時計遺伝子とその翻訳産物が織りなす転写フィードバックループが中心的な役割を果たしていると考えられ、時計遺伝子の転写制御が研究対象として華々しくスポットライトを浴びてきた。ところが最近の研究の進展に伴い、24時間という長い周期の分子振動形成や、この振動体が外界シグナルに対してダイナミックに応答する時計調節機構には、時間制御された時計タンパク質の翻訳後修飾が極めて重要な役割を果たすことが明らかになりつつある。私達はこれまでに、動物の概日時計システムを対象に分子レベルの解析を進め、ERK1/2、p38 MAPK、DYRK1A、GSK3β、CK1εなど数多くのタンパク質キナーゼが単独で、あるいは複数の組み合わせで特定の時計因子をリン酸化し、概日時計の振動周期や位相を調節することを示してきた(図)。つまり、CRY2はDYRK1AによるSer557のリン酸化を引き金にSer553がGSK-3βによりリン酸化され、プロテアソーム系により分解される。同様に、Per遺伝子の転写を負に制御するE4BP4は、Ser182のリン酸化を起点にCKIεによる二次リン酸化を受けて分解へと導かれる。一方、CLOCK-BMAL1複合体も時刻依存的なリン酸化制御を受け、DNA結合能、細胞内局在、タンパク質分解が 巧妙に制御されていることを明らかにした。本研究では、このような時計タンパク質の翻訳後修飾の組み合わせを修飾コードとして捉え、特に分子時計の修飾シグナルが果たす役割を明らかにする。これまで2年間のサポートを受け私達は、CLOCK-BMAL1複合体をリン酸化する酵素としてJNKを同定した(EMBO 2012)。JNKは光などの外界のシグナルを受けて活性化し、時計の中枢にリン酸化シグナルを伝えることにより、時計振動の周期と位相を調節する重要な分子であることが分かった。これに加えて私達は、CRYの安定性を調節する新規E3リガーセとしてFBXL21を同定した(Cell 2013)。CRYはFBXL3によりユビキチン化されてプロテアソームを介した分解に導かれることが報告されているが、驚いたことにFBXL21はユビキチン化することでCRYを安定化することを見出し、この2つの酵素による安定化と分解のバランスが時計振動に果たす重要性を示した。これからの2年間で概日時計機構における修飾シグナルの理解をさらに深めて行きたい。
【参考文献】
- Arisa Hirano, Kanae Yumimoto, Ryosuke Tsunematsu, Masaki Matsumoto, Masaaki Oyama, Hiroko Kozuka-Hata, Tomoki Nakagawa, Darin Lanjakornsiripan, Keiichi I. Nakayama and Yoshitaka Fukada. FBXL21 Regulates Oscillation of the Circadian Clock through Ubiquitination and Stabilization of Cryptochromes. Cell, 152, 1106-1118 (2013)
- Hikari Yoshitane, Sato Honma, Kiyomichi Imamura, Hiroto Nakajima, Shin-ya Nishide, Daisuke Ono, Hiroshi Kiyota, Naoya Shinozaki, Hirokazu Matsuki, Naoya Wada, Hirofumi Doi, Toshiyuki Hamada, Ken-ichi Honma and Yoshitaka Fukada. JNK regulates the photic response of the mammalian circadian clock. EMBO Reports, 13, 455-461 (2012)
- Megumi Hatori, Tsuyoshi Hirota, Michiko Iitsuka, Nobuhiro Kurabayashi, Shogo Haraguchi, Koichi Kokame, Ryuichiro Sato, Akira Nakai, Toshiyuki Miyata, Kazuyoshi Tsutsui and Yoshitaka Fukada. Light-dependent and circadian clock-regulated activation of sterol regulatory element-binding protein, X-box-binding protein 1 and heat shock factor pathways. Proc. Natl. Acad. Sci. USA., 108, 4864-4860 (2011)
- Nobuhiro Kurabayashi, Tsuyoshi Hirota, Mihoko Sakai, Kamon Sanada, and Yoshitaka Fukada. DYRK1A and GSK-3β: A dual kinase mechanism directing proteasomal degradation of CRY2 for circadian timekeeping. Mol. Cell. Biol., 30, 1757-1768 (2010)
- Momoko Sasaki, Hikari Yoshitane, Ngoc-Hien Du, Toshiyuki Okano and Yoshitaka Fukada. Preferential inhibition of BMAL2:CLOCK activity by PER2 reemphasizes its negative role and a positive role of BMAL2 in the circadian transcription. J. Biol. Chem., 284, 25149-25159( 2009)
- Hikari Yoshitane, Toshifumi Takao, Yoshinori Satomi, Ngoc-Hien Du, Toshiyuki Okano and Yoshitaka Fukada. Roles of CLOCK phosphorylation in suppression of E-box-dependent transcription. Mol. Cell. Biol., 29, 3675-3686 (2009)
- Naohiro Kon, Tsuyoshi Hirota, Takeshi Kawamoto, Yukio Kato, Tadashi Tsubota and Yoshitaka Fukada. Activation of TGF-β/activin signalling resets the circadian clock through rapid induction of Dec1 transcripts. Nature Cell Biol., 10, 1463-1469 (2008)
- Yuko Harada, Mihoko Sakai, Nobuhiro Kurabayashi, Tsuyoshi Hirota and Yoshitaka Fukada. Ser557-phosphorylated mCRY2 is degraded upon synergistic phosphorylation by GSK-3β. J. Biol. Chem., 280, 31714-31721(2005)
- Masao Doi, Toshiyuki Okano, Irene Yujnovsky, Paolo Sassone-Corsi and Yoshitaka Fukada. Negative control of circadian clock regulator E4BP4 by casein kinase Iε-mediated phosphorylation. Curr. Biol., 14, 975-980 (2004)
- Masao Doi, Yoshito Nakajima, Toshiyuki Okano and Yoshitaka Fukada. Light-induced phase-delay of the chicken pineal circadian clock is associated with the induction of cE4bp4, a potential transcriptional repressor of cPer2 gene. Proc. Natl. Acad. Sci. USA., 98, 8089-8094 (2001)











