
プライミングリン酸化反応の制御機構とその破綻による病態解明
 |
研究代表者 吉田清嗣 東京慈恵会医科大学生化学講座 |
【研究概要】
タンパク質の翻訳後修飾の一つであるリン酸化は、細胞内シグナル伝達など広く生命現象に関わる重要なイベントであり、細胞調節機構の根幹を担っている。この制御が破綻すると、癌をはじめとする様々な疾患の病因や進展に繋がることが知られている。リン酸化反応と基質の特性変化は通常一対一で生じるが、GSK-3に代表される一部のキナーゼでは、前もってプライミングキナーゼによってリン酸化された基質を認識しリン酸化することで、基質の特性変化を誘導する現象が観察されている。これは二つのキナーゼが働いてはじめて一つの基質に変化をもたらすことができる仕組みであり、リン酸化反応と基質の特性変化は二対一である。この意義としてフェイルセーフ機構(Failsafe mechanism)が提唱されており、重要な細胞調節システムに採用されていることが知られている。ところが、この詳細なメカニズムとプライミングキナーゼの基質特異性についてはその多くが不明である。
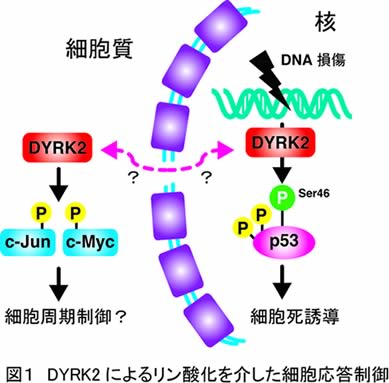
我々はこれまでに、癌の診断・治療への応用を視野に入れた研究を推進してきた。具体的には、ゲノムDNAに生じる損傷が癌の主な原因であることから、DNA損傷における細胞応答、特にアポトーシスと呼ばれる細胞死誘導の分子機構の解明に取り組んできた。DNA損傷によって惹起されるアポトーシスでは、癌抑制遺伝子であるp53がその中心的な働きを担っている。p53は多彩な修飾を受けてその機能を使い分けており、中でもSer46のリン酸化はアポトーシス誘導に必須と考えられている。ところが、どのようなキナーゼがDNA損傷に応答してSer46をリン酸化するのか明らかにされていなかった。そこで我々は、Ser46キナーゼの同定を目指し、世界に先駆けてSer46キナーゼとしてDYRK2を同定することに成功した(図1;Taira N, et al. Mol. Cell 2007)。我々はDYRK2の機能についてさらに解析を進めたところ、DYRK2の発現を抑制すると細胞周期において顕著なG1期の短縮が観察され、結果として細胞増殖能の亢進が見られるという興味深い知見を得た。さらにこのメカニズムとして、DYRK2がc-Junやc-Mycのプライミングキナーゼとして働き、その分解に寄与していることを見出した(図1、2)。In vitroではDYRKファミリーキナーゼがプライミングキナーゼとして働く可能性を示唆する報告があるものの、その細胞内での生理的役割は未だ不明である。そこで本研究では、DYRKキナーゼに焦点を当て、そのプライミングキナーゼとしての役割について明らかにすると共に、DYRKの発現や機能異常が発癌や癌の進展とどのように関わっているかについて検証する。

【参考文献】
- Taira N, Yamamoto H, Yamaguchi T, Miki Y, and Yoshida K. ATM augments nuclear stabilization of DYRK2 by inhibiting MDM2 in the apoptotic response to DNA damage. J. Biol. Chem. 285:4909-4919 (2010)
- Nihira K, Ando Y, Yamaguchi T, Kagami Y, Miki Y, and Yoshida K. Pim1 controls NF-κB signalling by stabilizing RelA/p65. Cell Death Differ. 17:689-698 (2010)
- Lu Z-G, Liu H, Yamaguchi T, Miki Y, and Yoshida K. Protein kinase Cδ activates RelA/p65 and nuclear factor-κB signaling in response to tumor necrosis factor-α. Cancer Res. 69:5927-5935 (2009)
- Nihira K, Taira N, Miki Y, and Yoshida K. TTK/Mps1 controls nuclear targeting of c-Abl by 14-3-3-coupled phosphorylation in response to oxidative stress. Oncogene 27:7285-7295 (2008)
- Kimura J, Nguyen ST, Liu H, Taira N, Miki Y, and Yoshida K. A functional genome-wide RNAi screen identifies TAF1 as a regulator for apoptosis in response to genotoxic stress. Nucleic Acids Res. 36:5250-5259 (2008)
- Yoshida K. Nuclear trafficking of pro-apoptotic kinases in response to DNA damage. Trends. Mol. Med. 14:305-313 (2008)
- Shinagawa H, Miki Y, and Yoshida K. BRCA1-mediated ubiquitination inhibits topoisomerase IIα activity in response to oxidative stress. Antioxid. Redox. Signal. 10:939-950 (2008)
- Liu H, Lu Z-G, Miki Y, and Yoshida K. Protein kinase C δ induces transcription of the TP53 tumor suppressor by controlling death-promoting factor Btf in the apoptotic response to DNA damage. Mol. Cell. Biol. 27:8480-8491 (2007)
- Yamaguchi T, Miki Y, and Yoshida K. The USP11 deubiquitinating enzyme controls an IKKα-p53 signaling pathway in response to TNFα. J. Biol. Chem. 282:33943-33948 (2007)
- Taira N, Nihira K, Yamaguchi T, Miki Y, and Yoshida K. DYRK2 is targeted to the nucleus and controls p53 via Ser46 phosphorylation in the apoptotic response to DNA damage. Mol. Cell 25:725-738 (2007)











