
炎症シグナルによるErbBチロシンキナーゼのSer/Thrリン酸化とがん悪性化
 |
研究代表者 櫻井宏明 富山大学・大学院医学薬学研究部(薬学)・がん細胞生物学研究室 http://www.pha.u-toyama.ac.jp/cliche2/index-j.html |
【研究概要】
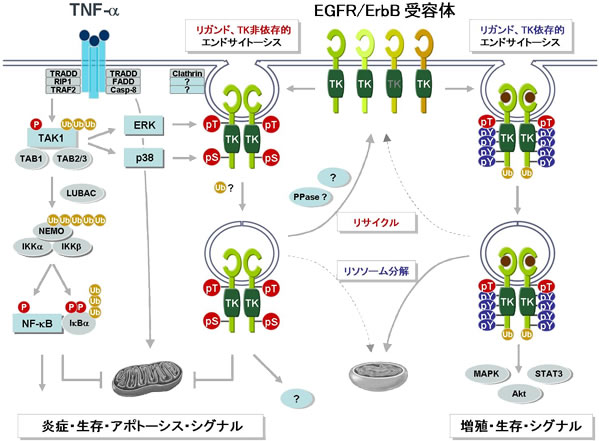
TNF-αは発がん・がんの悪性化や自己免疫疾患などの様々な疾患との関わりが明らかにされており、そのシグナル伝達系の解析が進められてきた。最近、上皮間葉転換(EMT)などの制御にも関与していることが明らかになり、がん微小環境でのがん-間質相互作用におけるがん悪性化促進因子としての役割にも注目が集まっている。TNF-αシグナルは主にNF-κBとMAPKへ伝達されるが、我々はMAP3Kの一つであるTAK1がNF-κB活性化に関与していることや、IκB kinase (IKK)がNF-κB p65サブユニットも直接リン酸化することなどを明らかにしてきた。また、TAK1シグナルが大腸がんの肺転移に関与していることなど、炎症によるがん悪性化の分子機構に興味を持って研究を進めている。
最近、TNF-αシグナルにおいて、がん分子標的治療で注目されているチロシンキナーゼ型受容体EGFRのSer-1046/1047およびThr-669がリン酸化され、速やかにエンドサイトーシスすることを見出した。この新しい経路は、TAK1の下流でそれぞれp38とERKを介してリン酸化され、NF-κBと完全に独立した抗アポトーシスシグナルとして機能している。EGFR特異的リガンドによるEGFR活性化シグナルは細胞内のチロシンキナーゼによるTyr残基の自己リン酸化が重要であると考えられてきたが、興味深いことにTNF-αによるEGFRのSer/Thr残基のリン酸化にはEGFRチロシンキナーゼ活性は全く関与していない。したがって、Ser/Thrリン酸化はEGFR機能の中で見落とされてきた翻訳後修飾であり、その機能解析は発がん・がんの悪性化・進展をはじめとする広範なEGFR機能を理解するために重要であると考えられる。
そこで本研究では、TNF-αによるEGFR/ErbB受容体の制御機構、および生理機能の解明を目指す。Ser/Thrリン酸化によって起こるエンドサイトーシスの分子機構について、EGFRリガンドによるTyrリン酸化依存的な場合との比較検討を行う。また、EGFRや他のErbBファミリーにも注目し、炎症シグナルによってリン酸化を受ける新しいSer/Thr残基の探索を行うとともに、ヒト肺がんや乳がん細胞株におけるリン酸化制御機構の解析を行う。また、Ser/Thr残基がリン酸化されたEGFRと相互作用する分子の探索やEGFR依存的に発現変動する遺伝子の探索を行い、炎症シグナルにおけるリガンド非依存的なEGFRリン酸化の生理機能を分子細胞生物学的に解明し、がん分子標的治療分野へ基礎的な情報の提供を行う。
【参考文献】
- Refaat A., Zhou Y., Suzuki S., Takasaki I., Koizumi K., Yamaoka S., Tabuchi Y., Saiki I., and Sakurai H.: Distinct roles of transforming growth factor-b-activated kinase 1 (TAK1)-c-Rel and interferon regulatory factor 4 (IRF4) pathways in human T cell lymphotropic virus 1-transformed T helper 17 cells producing interleukin-9. J. Biol. Chem. 286: 21092–21099, 2011.
- Suzuki S., Zhou Y., Refaat A., Takasaki I., Koizumi K., Yamaoka S., Tabuchi Y., Saiki I., and Sakurai H.: Human T cell lymphotropic virus 1 manipulates interferon regulatory signals by controlling the TAK1-IRF3 and IRF4 pathways. J. Biol. Chem. 285: 4441-4446, 2010.
- Nishimura M., Shin M.S., Singhirunnusorn P., Suzuki S., Kawanishi M., Koizumi K., Saiki I., and Sakurai H.: TAK1-mediated serine/threonine phosphorylation of epidermal growth factor receptor via p38/extracellular signal-regulated kinase: NF-kB-independent survival pathways in tumor necrosis factor alpha signaling. Mol. Cell. Biol. 29: 5529-5539, 2009.
- Suzuki S., Singhirunnusorn P., Mori A., Yamaoka S., Kitajima I., Saiki I., and Sakurai H.: Constitutive activation of TAK1 by HTLV-1 Tax-dependent overexpression of TAB2 induces activation of JNK-ATF2, but not IKK-NF-kB. J. Biol. Chem. 282: 25177-25181, 2007.
- Singhirunnusorn P., Ueno Y., Matsuo M., Suzuki S., Saiki I., and Sakurai H.: Transient suppression of ligand-mediated activation of epidermal growth factor receptor by TNF-a through the TAK1-p38 signaling pathway. J. Biol. Chem. 282: 12698-12706, 2007.
- Singhirunnusorn P., Suzuki S., Kawasaki N., Saiki I., and Sakurai H.: Critical roles of threonine 187 phosphorylation in cellular stress-induced rapid and transient activation of transforming growth factor-b-activated kinase 1 (TAK1) in a signaling complex containing TAK1-binding protein TAB1 and TAB2. J. Biol. Chem. 280: 7359-7368, 2005.
- Sakurai H., Suzuki S., Kawasaki N., Nakano H., Okazaki T., Chino A., Doi T., and Saiki I.: Tumor necrosis factor-a-induced IKK phosphorylation of NF-kB p65 on serine 536 is mediated through the TRAF2, TRAF5 and TAK1 signaling pathway. J. Biol. Chem. 278: 36916-36923, 2003.
- Sakurai H., Chiba H., Miyoshi H., Sugita T., and Toriumi W.: IkB kinases phosphorylate NF-kB p65 subunit on serine 536 in the transactivation domain. J. Biol. Chem. 274: 30353-30356, 1999.
- Sakurai H., Miyoshi H., Toriumi W., and Sugita T.: Functional interactions of transforming growth factor b-activated kinase 1 with IkB kinases to stimulate NF-kB activation. J. Biol. Chem. 274: 10641-10648, 1999.
- Sakurai H., Shigemori N., Hasegawa K., and Sugita T.: TGF-b-activated kinase 1 stimulates NF-kB activation by an NF-kB-inducing kinase-independent mechanism. Biochem. Biophys. Res. Commun. 243: 545-549, 1998.











