
ポリグルタミン酸化修飾イメージングの基盤技術開発
 |
研究代表者 池上浩司 浜松医科大学医学部 解剖学講座(細胞生物学分野) http://www.hama-med.ac.jp/mt/setou/ja/laboratory/ikegami/ |
【研究概要】
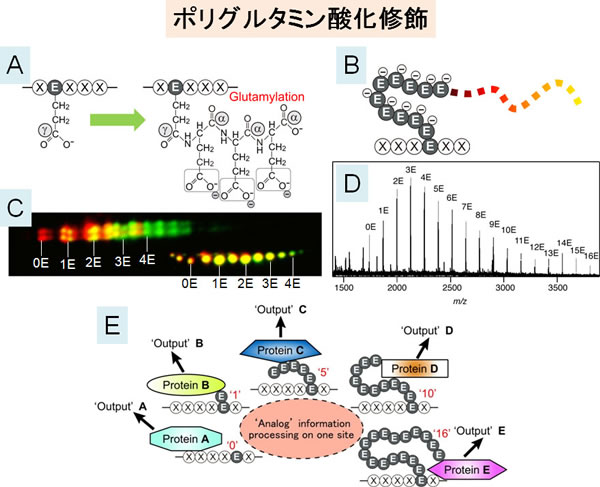
タンパク質ポリグルタミン酸化修飾(Poly-Glutamylation)は、被修飾タンパク質に複数個(1個から数10個)のグルタミン酸からなるポリグルタミン酸鎖が枝分かれ状に付加される非常にユニークな翻訳後修飾である(図A、B)。我々はこれまで、修飾を担う酵素の同定(Ikegami et al, JBC 2006; Ikegami et al, FEBS 2008; Ikegami & Setou, FEBS 2009)、修飾の生理学的重要性の解明(Ikegami et al, PNAS 2007; Ikegami et al, PNAS 2010)に成功してきた。更に最近、脱修飾を担う酵素の同定(Kimura et al, JBC 2010)にも成功した。修飾・脱修飾酵素の同定により、修飾のON/OFF制御機構の理解に向けた地盤が確立された。
修飾レベルの定量法として、グルタミン酸付加による被修飾タンパク質の等電点シフトを検出する高解像度二次元電気泳動法(図C)、グルタミン酸付加による質量変化を検出する質量分析法(図D)が確立されている。一方、修飾の局在情報の可視化は特異的抗体による免疫染色法に頼っている。0個から数10個までの段階的な修飾による『アナログ様』のシグナル伝達(図E)が期待されるにも関わらず、修飾の時空間ダイナミクスの解析は、修飾の有無を議論するのみの非常に大まかな解析に留まっている。
本研究では、プロテオミクス技術、質量分析技術、遺伝子・タンパク質操作技術、FRET技術等を駆使し、修飾レベル特異的認識蛍光プローブによる修飾状態可視化の検討、直接質量分析(Imaging Mass Spectrometry)による修飾状態の定量的可視化の検討を通し、ポリグルタミン酸化修飾イメージングの基盤技術開発を目指す。同時に、新たに提唱しつつある『ポリグルタミン酸病』の解析にイメージング技術を応用していきたい。
【参考文献】
- Ikegami K, Sato S, Nakamura K, Ostrowski LE, Setou M. Tubulin polyglutamylation is essential for airway ciliary function through the regulation of beating asymmetry. Proc. Natl. Acad. Sci. USA 107, 10490-10495 (2010).
- Ikegami K, Setou M. Unique post-translational modifications in specialized microtubule architecture. Cell Struct. Funct. 35, 15-22 (2010).
- Kimura Y, Kurabe N, Ikegami K, Tsutsumi K, Konishi Y, Kaplan OI, Kunitomo H, Iino Y, Blacque OE, Setou M. Identification of tubulin deglutamylase among Caenorhabditis elegans and mammalian cytosolic carboxypeptidases (CCPs). J. Biol. Chem. 285, 22936-22941 (2010).
- Morita Y, Ikegami K, Goto-Inoue N, Hayasaka T, Zaima N, Tanaka H, Uehara T, Setoguchi T, Sakaguchi T, Igarashi H, Sugimura H, Setou M, Konno H. Imaging mass spectrometry of gastric carcinoma in formalin-fixed paraffin-embedded tissue microarray. Cancer Sci. 101, 267-273 (2010).
- Ikegami K, Setou M. TTLL10 can perform tubulin glycylation when co-expressed with TTLL8. FEBS Lett. 583, 1957-1963 (2009).
- Mukai M, Ikegami K, Sugiura Y, Takeshita K, Nakagawa A, Setou M. Recombinant mammalian tubulin polyglutamylase TTLL7 performs both initiation and elongation of polyglutamylation on beta-tubulin through a random sequential pathway. Biochemistry 48, 1084-1093 (2009).
- Ikegami K, Horigome D, Mukai M, Livnat I, MacGregor GR, Setou M. TTLL10 is a protein polyglycylase that can modify nucleosome assembly protein 1. FEBS Lett. 582, 1129-1134 (2008).
- Ikegami K, Heier RL, Taruishi M, Takagi H, Mukai M, Shimma S, Taira S, Hatanaka K, Morone N, Yao I, Campbell PK, Yuasa S, Janke C, MacGregor GR, Setou M. Loss of alpha-tubulin polyglutamylation in ROSA22 mice is associated with abnormal targeting of KIF1A and modulated synaptic function. Proc. Natl. Acad. Sci. USA 104, 3213-3218 (2007).
- Ikegami K, Mukai M, Tsuchida J, Heier RL, MacGregor GR, Setou M. TTLL7 is a mammalian beta-tubulin polyglutamylase required for growth of MAP2-positive neurites. J. Biol. Chem. 281, 30707-30716 (2006).











