
細胞外ドメインシェディングによるシグナル伝達制御の病態における意義
 |
研究代表者 西 英一郎 京都大学大学院医学研究科 循環器内科 http://kyoto-u-cardio.jp/kisokenkyu/sentan-bunshi/ |
【研究概要】
膜近傍部でのタンパク分解により、膜タンパク質の細胞外ドメインが不可逆的に切断される翻訳後修飾を、細胞外ドメインシェディング(以下シェディングと略す)という。様々な受容体や接着分子、増殖因子やサイトカインの前駆体、さらにNotchやアミロイド前駆体蛋白質(APP)など、多岐にわたる膜タンパク質がシェディングによる機能制御を受けている。例えば膜型受容体のシェディングは、シグナル遮断、持続的活性化、可溶型受容体(切断された細胞外ドメイン)の産生など、基質受容体と状況に応じて多彩な機能を発揮する。TNF-alphaやEGFファミリーなど、リガンドとなるサイトカインや増殖因子もシェディングによって活性化されるものが多い。さらにNotchのように、シェディングが先行することで、γセクレターゼによる膜内切断(RIP)が誘導され、遊離した細胞質ドメインが新たな機能を持つ(Notchの場合、転写調節機能)分子も多く、シェディングは膜タンパク質の機能変換や多機能化を介してシグナル伝達制御を担う重要な翻訳後修飾と言えよう。しかしながら、これまでシェディング制御、特にその活性化の分子機構、さらにその生体における意義は明らかではなかった。
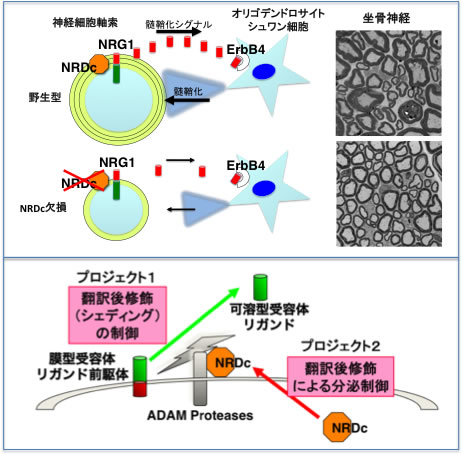
我々は、増殖因子HB-EGFの細胞表面受容体として同定したメタロプロテアーゼ、ナルディライジン (NRDc)(文献5)が、ADAMプロテアーゼの活性化を介してHB-EGFの細胞外ドメインシェディングを増強すること(文献4)、NRDcのシェディング増強効果はHB-EGFに限定されず、TNF-alphaやアミロイド前駆体タンパクを含む広範な膜蛋白質に及ぶことを明らかにした(文献2 3)。さらにNRDc欠損マウスの解析より、NRDcがニューレギュリン1 (NRD1) のシェディングを介して、中枢および末梢神経の軸索・髄鞘形成を司ることを明らかにし、NRDcが個体レベルにおいても、シェディング調節因子として重要であることを明らかにした(文献1、図上パネル)。さらにNRDc欠損マウスは、神経系表現型以外にも、成長障害(胎内・生後)、エネルギー代謝異常、循環動態異常など、多彩な表現型を呈し、NRDcによるシェディング制御機構が、さまざまな生命現象において重要な役割を果たしていることが示唆された。また同マウスは複数の炎症疾患モデルにおいて顕著な炎症抵抗性を呈しており,さらに我々が開発した高感度NRDc測定系による検討で、血清NRDcが炎症性疾患患者で上昇していることも明らかになった。以上の結果は、NRDcが炎症性疾患の病態生理上重要な働きをしていることを示しており、これまでは細胞実験からの推論に過ぎなかった「病態におけるシェディング制御の重要性」を示唆している(図下パネル:プロジェクト1)。
一方NRDcの細胞外機能を追求する上で、どうしても明らかにしなければいけない点がある。シェディング増強活性は細胞外における機能だが、NRDcはシグナルペプチドを有さない可溶型酵素であり、その分泌機構は不明である。これまで数多くのシグナルペプチドを持たないタンパク質、例えばFGF2やIL-1b、HMGB1などが、古典的分泌経路とは異なる経路を介して細胞外に分泌されることが明らかになっている。非古典的分泌の分子機構解明は、細胞内トラフィック分野に残された大きな課題であり、いくつかの分子で非古典的分泌の翻訳後修飾依存性が報告されているものの、同機序を普遍的に説明できるメカニズムは未だ解明されていない。NRDcの分泌は、ホルボールエステルなどで誘導されることがわかっており、何らかの翻訳後修飾がスイッチとなっている可能性がある。分泌機構の解明が、シェディング活性化という細胞外機能の解明につながることは明らかであり、本プロジェクトでは、まだ解明されていないNRDcの翻訳後修飾プロフィールを明らかにすることで、分泌機構との関連を明らかにしたい(図下パネル:プロジェクト2)。
【参考文献】
- Ohno, M., Hiraoka, Y., Matsuoka, T., Tomimoto, H., Takao, K.,
Miyakawa, T., Oshima, N., Kiyonari, H., Kimura, T., Kita, T., and *Nishi, E. Nardilysin Regulates Axonal
Maturation and Myelination in the Central and Peripheral Nervous System
(*Corresponding author)
Nat. Neurosci. 12: 1506-1513 (2009) - Hiraoka, Y., Yoshida, K., Ohno, M., Matsuoka, T., Kita, T., *Nishi,
E. Ectodomain shedding of TNF-alpha is enhanced by nardilysin via
activation of ADAM proteases.
Biochem. Biophs. Res. Commun. 370: 154-8 (2008) - Hiraoka, Y., Ohno, M., Yoshida, K., Okawa, K., Tomimoto, H., Kita,
T. and *Nishi, E. Enhancement of alpha-secretase cleavage of amyloid
precursor protein by a metalloendopeptidase nardilysin.
J Neurochem. 102: 1595-1605 (2007) - *Nishi, E., Hiraoka, Y., Yoshida, K., Okawa, K. and Kita,
T. Nardilysin enhances ectodomain shedding of heparin-binding EGF-like growth
factor through activation of TNF-alpha converting enzyme.
J. Biol. Chem. 281, 31164-72 (2006) - Nishi, E., Prat, A., Veronique, H., Elenius, K. and
Klagsbrun, M. N-arginine dibasic convertase is a specific receptor for
heparin-bnding EGF-like growth factor that mediates cell migration
EMBO J. 20: 3342-50 (2001)











