
プロリン異性化酵素Pin1、PAR14標的蛋白の網羅的同定と病態への関与
 |
研究代表者 浅野知一郎 広島大学大学院医歯薬学総合研究科 探索医科学講座 医化学研究室 http://home.hiroshima-u.ac.jp/ikagaku/ |
【研究概要】
ポストゲノム時代において、タンパクの翻訳後修飾による細胞現象や病態への関与解明は大きく残されたテーマである。その中で、プロリン異性化酵素は、特定のmotifに結合し、cis体からtrans体に変化させることでタンパクの機能変化を生じさせるユニークな酵素である。 我々はインスリンシグナルにおいて中心的役割を果たしているIRS-1の結合蛋白を検索する過程で、代表的なプロリン異性化酵素であるPin1がIRS-1に結合することで、 インスリンによるIRS-1のチロシンリン酸化からAkt活性化を顕著に亢進させることを見出した(JBC,2011)。さらに、Pin1は、CREBのco-activatorであるCRTC familyにも結合し、CRTCを核内から細胞質へと移動させることで、CRE転写活性低下を導き、肝臓においては糖新生を抑制することを報告した(JBC, 2010)。また、興味深いことに、Pin1を発現抑制あるいはPin1の活性阻害薬を用いると、脂肪細胞の分化が高度に抑制される。逆に、肝臓にPin1を過剰発現させると、肝臓に脂肪蓄積が促進される。
現在まで、Pin1の発現量異常や遺伝子変異は、癌やアルツハイマー病、パーキンソン病などの発症に関与することが、Nature等の一流誌に報告されている。一方、これまで、Pin1が代謝調節に関係する報告はなく、我々が世界に先駆けて認識したことである。我々は、高脂肪食を負荷したマウスの肝臓、筋肉、脂肪組織中ではPin1の発現量が10倍近くも顕著に増加することを見出しており、メタボリック症候群発症の分子機序にPin1による翻訳後修飾が関与していると考えている(図1)。実際、さらに、Pin1 KOマウスでは、コリン・メチオニン欠乏食(MCD)による非アルコール性脂肪性肝炎(NASH)の発症も強く抑制されるという知見が得られつつある。
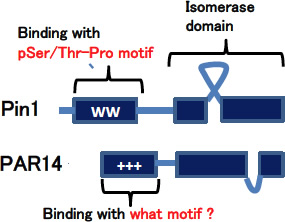
図1:Pin1がメタボリック症候群発症に関与する仮説図
一方、Pin1 KOマウスでは類似蛋白であるPAR14の発現が増加しており、Pin1欠損の影響をある程度、代償している可能性が高い。Pin1ではN端側のWWドメインを介してリン酸化Ser/Thr-Pro motifに結合するのに対し、PAR14のN端側の部位はDNAのAT richな領域との結合が報告されている(図2)。しかし、我々は、PAR14も多くの蛋白を標的とすると考えており、そのターゲット蛋白を網羅的に同定する予定である。以上を通じて、Pin1とPAR14の両プロリン異性化酵素について、代謝異常を中心とする疾患への関与を解明し、最終的には新規治療への応用を目指したい。
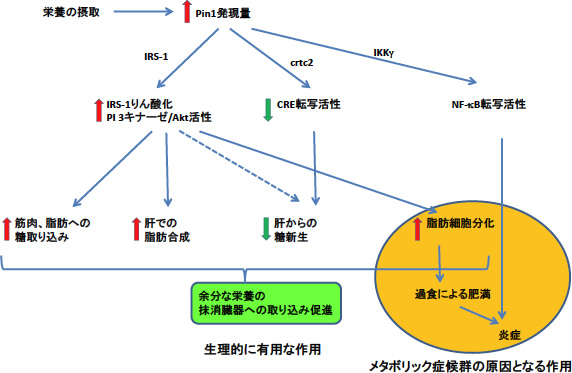
図2:Pin1とPAR14の構造・結合モチーフの違い
【参考文献】
- Nakatsu, Y.,
Sakoda, H., kushiyama, A., Zhang, J., Ono, H., Fujishiro, M., Fukushima, T.,
Yoneda, M., Ohno, H., Horike, N., Kanna, M., Tsuchiya, Y., Kamata, H.,
Nishimura, F., Isobe, T., Ogihara, T., Katagiri, H., Takahashi, S., Kurihara,
H., Uchida, T., and Asano, T.
Peptidyl-prolyl Cis/Trans Isomerase NIMA-interacting 1 Associates with Insulin Receptor Substrate-1 and Enhances Insulin Actions and Adipogenesis.
J. Biol. Chem. 286, 20812-22 (2011) - Kamata, H., Tsuchiya, Y., and Asano T.
IkBβ is a positive and negative regulator of NFκB activity during inflammation.
Cell Res. 20, 1178-80 (2010) - Nakatsu, Y., Sakoda, H., Kushiyama, A., Ono, H., Fujishiro,
M., Horike, N., Yoneda, M., Ohno, H., Kamata, H., Tahara, H., Isobe, T.,
Nishimura, F., Katagiri, H., Oka, Y., Fukushima, T., Takahashi, SI., Kurihara,
H., Uchida, T., and Asano, T.
Pin1 associates with and induces translocation of CRTC2 to the cytosol, thereby suppressing CRE transcriptional activity
J. Biol. Chem. 43, 33018-33027 (2010) - Tsuchiya, Y., Asano, T., Nakayama, K., Kato, T., Karin, M., and Kamata, H.
Nuclear IKKβ is an adaptor protein for IκBα ubiquitination and degradation in UV-induced NF-κB activation.
Molecular Cell 39, 570-82 (2010) - Horike, N., Sakoda, H., Kushiyama, A., Ono, H.,
Fujishiro, M., Kamata, H., Nishiyama, K., Uchijima, Y., Kurihara, Y., Kurihara,
H., and Asano, T. AMPK activation increases phosphorylation of GSK3beta and
thereby reduces CRE transcriptional activity and PEPCK-C gene expression in the
liver.
J. Biol. Chem 283, 33902-10 (2008) - Asano, T., Fujishiro, M., Kushiyama, A., Nakatsu,
Y., Yoneda, M., Kamata, H., and Sakoda, H.
Role of phosphatidylinositol 3-kinase activation on insulin action and its alteration in diabetic conditions.
Biol. Pharm. Bull. 30, 1610-6 (2007) - Anai, M., Shojima, N., Katagiri, H.,
Ogihara, T., Sakoda, H., Onishi, Y., Ono, H., Fujishiro, M., Fukushima, Y.,
Horike, N., Viana, A., Kikuchi, M., Noguchi, N., Takahashi, SI., Takata, K.,
Oka, Y., Uchijima, Y., Kurihara, H. and Asano,
T.
A novel PKB/AKT-binding protein enhanced PKB kinase activity and regulates DNA synthesis
J. Biol. Chem. 280, 18525-35 (2005) - Ono, H., Shimano, H., Katagiri, H., Yahagi, N., Sakoda, H., Onishi, Y., Anai,
M., Ogihara, T., Fujishiro, M., Viana, A.Y.I., Fukushima, Y., Abe, M., Shojima, N., Kikuchi, M., Yamada, N., Oka, Y., and Asano, T. Hepatic Akt Activation Induces
Marked Hypoglycemia, Hepatomegaly and Hypertriglyceridemia with SREBP
Involvement
Diabetes 52, 2905-2913 (2003) - Sakoda,
H., Gotoh, Y., Katagiri, H., Kurokawa, M., Ono, H., Onishi, Y., Anai, M.,
Ogihara, T., Fujishiro, M., Fukushima, Y., Abe, M., Shojima, N, Kikuchi, M.,
Oka, Y., Hirai, H., and Asano, T. Differing roles of Akt and SGK in glucose metabolism, DNA
synthesis and oncogenic activity
J. Biol. Chem. 278, 25802-25807 (2003) - Ogihara, T., Isobe, T., Ichimura, T., Taoka, M., Funaki, M., Sakoda, H.,
Onishi, Y., Inukai,
K.,Anai, M., Fukushima, Y., Kikuchi, M., Yazaki, Y., Oka, Y., Asano, T.
14-3-3 protein binds to IRS-1, one of the binding sites of which is in the phosphotyrosine binding (PTB) domain.
J. Biol. Chem 272, 25267- 74 (1997)











