
Pin1プロテオミクスを用いた疾患特異的リン酸化タンパク質の網羅的探索
 |
研究代表者 梁 明秀 横浜市立大学・大学院医学研究科・微生物学 http://www-user.yokohama-cu.ac.jp/~saikin/ |
【研究概要】
タンパク質のリン酸化は増殖や分化といった数多くの細胞の機能を調節する上で極めて重要なメカニズムの1つである。しかしながら、いかにしてリン酸化されたタンパク質がリン酸化に引き続いて機能を大きく変化させるかという機構については不明な点が多い。
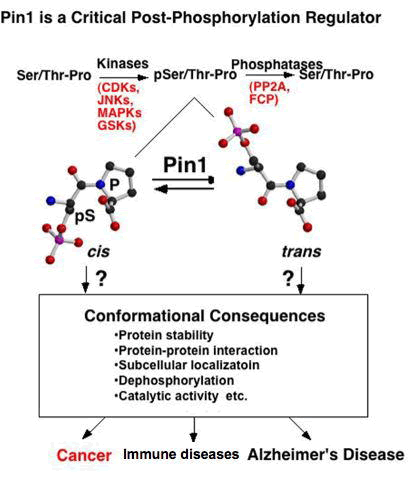
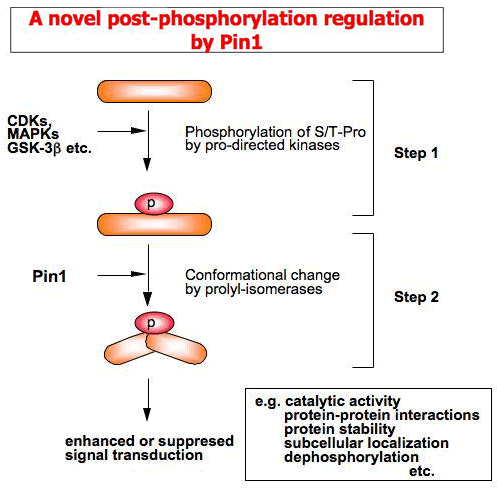
ペプチジルプロリルイソメラーゼPin1はリン酸化されたSer/Thr-Pro というモチーフに結合し、そのペプチド結合を介してタンパク質の構造をシス・トランスに異性化させることにより、リン酸化タンパク質の機能を調節する新しいタイプのレギュレータである。 この新規のリン酸化後調節機構は標的タンパク質の活性、タンパク質—タンパク質結合、細胞内局在、さらには安定性等を変化させ、リン酸化タンパク質の機能発現に重要な役割を果たすことが知られている。また、Pin1がリン酸化タンパク質に結合して構造が変化することで、ユビキチン化や脱リン酸化などの、他の翻訳後修飾のスイッチのON/OFFが調節されていることが知られている。
最近の共同研究により、Pin1はがん、免疫疾患および神経変性疾患等の難治性疾患の病態形成に極めて重要な役割を果たすことが明らかになっている。Pin1の標的となるリン酸化タンパク質は多岐に渡り、細胞や組織の違いによって異なる。また、同一細胞/組織であっても、正常時と疾患時では、基質のリン酸化状態が異なることで、そのレパートリーが大きく変わることが考えられる。
本研究プロジェクトではPin1を分子プローブとした新しいリン酸化プロテオミクス解析を独自に開発し、疾患特異的にPin1と結合する機能的リン酸化タンパク質を同定する。これらのデータを基盤として、癌、免疫疾患、アルツハイマー病などのタンパク質翻訳後修飾の異常にともなう疾患形成やその分子メカニズムを明らかにする
【参考文献】
- Nishi, M., Akutsu, H., Masui, S., Kondo, A., Nagashima, Y., Kimura, H., Perrem, K., Shigeri, Y., Toyoda, M., Okayama, A., Hirano, H., Umezawa, A., Yamamoto, N., Lee, S. W. and Ryo, A.: A distinct role for Pin1 in the induction and maintenance of pluripotency. J. Biol Chem 286: 11593-11603, 2011
- Ryo, A., Wulf, G., Lee, T. H. and Lu, K. P.: Pinning down HER2-ER crosstalk in SMRT regulation. Trends Biochem Sci 34: 162-165, 2009
- Ryo, A., Tsurutani, N., Ohba, K., Kimura, R., Komano, J., Nishi, M., Soeda, H., Hattori, S., Perrem, K., Yamamoto, M., Chiba, J., Mimaya, J., Yoshimura, K., Matsushita, S., Honda, M., Yoshimura, A., Sawasaki, T., Aoki, I., Morikawa, Y. and Yamamoto, N.: SOCS1 is an inducible host factor during HIV-1 infection and regulates the intracellular trafficking and stability of HIV-1 Gag, Proc Natl Acad Sci USA 105: 294-299, 2008
- Ryo, A., Hirai, A., Nishi, M., Liou, Y. C., Perrem, K., Lin, S. C., Hirano, H., Lee, S. W. and Aoki, I.: A suppressive role of the prolyl isomerase Pin1 in cellular apoptosis mediated by the death-associated protein Daxx. J Biol Chem 282: 36671-36681, 2007
- Suizu, F., Ryo, A., Wulf, G., Lim, J. and Lu, K. P.: Pin1 regulates centrosome duplication, and its overexpression induces centrosome amplification, chromosome instability, and oncogenesis. Mol Cell Biol 26: 1463-1479, 2006
- Ryo, A., Togo, T., Nakai, T., Hirai, A., Nishi, M., Yamaguchi, A., Suzuki, K., Hirayasu, Y., Kobayashi, H., Perrem, K., Liou, Y. C. and Aoki, I.: Prolyl-isomerase Pin1 accumulates in lewy bodies of parkinson disease and facilitates formation of alpha-synuclein inclusions. J Biol Chem 281: 4117-4125, 2006
- Ryo, A., Uemura, H., Ishiguro, H., Saitoh, T., Yamaguchi, A., Perrem, K., Kubota, Y., Lu, K. P. and Aoki, I.: Stable suppression of tumorigenicity by Pin1-targeted RNA interference in prostate cancer. Clin Cancer Res 11: 7523-7531, 2005
- Ryo, A., Suizu, F., Yoshida, Y., Perrem, K., Liou, Y. C., Wulf, G., Rottapel, R., Yamaoka, S. and Lu, K. P.: Regulation of NF-kappaB signaling by Pin1-dependent prolyl isomerization and ubiquitin-mediated proteolysis of p65/RelA. Mol Cell 12: 1413-1426, 2003
- Ryo, A., Liou, Y. C., Wulf, G., Nakamura, M., Lee, S. W. and Lu, K. P.: PIN1 is an E2F target gene essential for Neu/Ras-induced transformation of mammary epithelial cells. Mol Cell Biol 22: 5281-5295, 2002
- Ryo, A., Nakamura, M., Wulf, G., Liou, Y. C. and Lu, K. P.: Pin1 regulates turnover and subcellular localization of beta-catenin by inhibiting its interaction with APC. Nat Cell Biol 3: 793-801, 2001











