
ポリ(ADP-リボシル)化による細胞の分裂と運動の制御
 |
研究代表者 清宮啓之 公益財団法人がん研究会がん化学療法センター分子生物治療研究部 http://www.jfcr.or.jp/chemotherapy/department/molecular_biotherapy/ |
【研究概要】
ポリ(ADP-リボシル)化は、NAD+を基質として蛋白質にADP-リボースを連鎖付加する反応であり、蛋白質に最も大きな物性変化を与える翻訳後修飾の一つである。この反応を触媒するPARP酵素ファミリーは17種類のメンバー遺伝子によって構成され、うち少なくとも10種類は酵素活性を持つことが確認されている。代表的メンバーであるPARP-1は、DNAの損傷修復に寄与し、虚血再還流の際に「パータナトス(parthanatos)」と呼ばれる細胞死を誘導することから、PARP阻害剤はそのような細胞傷害性疾患の治療薬に応用できると期待されている。さらに、PARP阻害剤はがん抑制遺伝子BRCA1・BRCA2などの欠損条件下でいわゆる「合成致死性(synthetic lethality)」を発揮するため、BRCA変異がんやトリプルネガティブ乳がんをはじめ、様々ながんを対象とした新薬臨床試験が進行している。
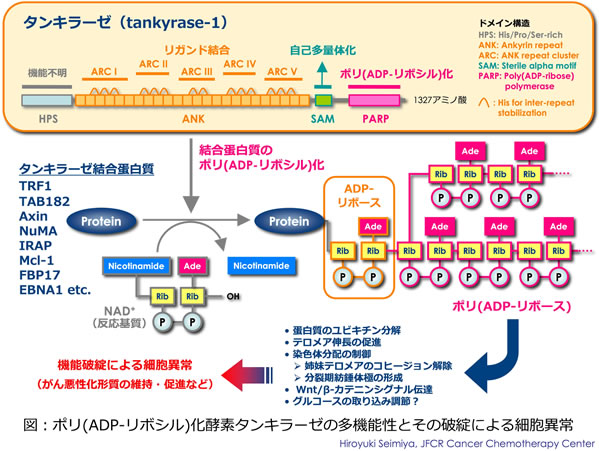
我々は、タンキラーゼ(tankyrase-1/PARP-5aおよびtankyrase-2/PARP-5b)と呼ばれるPARPメンバーに着目し、基礎・応用の両面から研究を推進している(図)。タンキラーゼはテロメア蛋白質TRF1をポリ(ADP-リボシル)化し、これをテロメアから遊離させることにより、テロメラーゼによるテロメア伸長を促進する(総説:Seimiya, Br J Cancer, 2006)。テロメラーゼは、細胞増殖に伴うテロメアの短縮を防ぎ、がん細胞の無限分裂を支える酵素である。我々は、タンキラーゼの阻害がテロメラーゼ阻害剤の制がん効果を増強させること、逆にタンキラーゼの機能亢進がテロメラーゼ阻害剤耐性をもたらすことを示した(Seimiya et al., Cancer Cell, 2005)。他方、タンキラーゼの分子内に存在するアンキリン領域が5つの独立したリガンド結合部位として機能することを見出し、これらの部位をANK repeat clusters(ARC)と名付けた(Seimiya et al., MCB, 2004)。ARCには様々な蛋白質が結合すること、これらの蛋白質およびタンキラーゼが細胞内の様々な部位に分布することから、タンキラーゼによって司られるポリ(ADP-リボシル)化反応は、これまでの予想を超えた多様な細胞機能に関与している可能性が考えられる。
タンキラーゼは、姉妹染色分体のテロメア・コヒージョンを解除すること、分裂期の中心体近傍で紡錘体の形成に寄与することなど、細胞分裂との関連性が指摘されている。我々は最近、タンキラーゼがTRF1のポリ(ADP-リボシル)化を介し、分裂期キナーゼAurora-Aの過剰発現による細胞分裂異常を抑制することを見出した(Ohishi et al., Cancer Res, 2010)。本研究ではこれらの知見を踏まえ、タンキラーゼからTRF1への分子連係の破綻がどのようなメカニズムを介して細胞分裂の異常につながるかを検討する。また、タンキラーゼ1によるポリ(ADP-リボシル)化反応が細胞の運動性に関与する可能性についても精力的に検討する予定である。これらにより、ポリ(ADP-リボシル)化修飾シグナルを標的とした、新たながん治療戦略を提唱したい。PARPは酵母ゲノムには存在しないため、本研究は翻訳後修飾によるシグナル伝達機構の進化過程を探るうえでも重要な手掛かりを与えるかもしれない。
【参考文献】
- Ohishi, T., Hirota, T., Tsuruo, T. and Seimiya, H. TRF1 mediates mitotic abnormalities induced by Aurora-A overexpression. Cancer Res, 70, 2041-2052, (2010).
- Hatsugai, K., Ohishi, T., Sugimoto, Y. and Seimiya, H. Tankyrase-1 assembly to large protein complexes blocks its telomeric function. FEBS Lett, 584, 3885-3890, (2010).
- Yashiroda, Y., Okamoto, R., Hatsugai, K., Takemoto, Y., Goshima, N., Saito, T., Hamamoto, M., Sugimoto, Y., Osada, H., Seimiya, H. and Yoshida, M. A novel yeast cell-based screen identifies flavone as a tankyrase inhibitor. Biochem Biophys Res Commun, 394, 569-573, (2010).
- Seki, T., Yuasa, S., Oda, M., Egashira, T., Yae, K., Kusumoto, D., Nakata, H., Tohyama, S., Hashimoto, H., Kodaira, M., Okada, Y., Seimiya, H., Fusaki, N., Hasegawa, M. and Fukuda, K. Generation of induced pluripotent stem cells from human terminally differentiated circulating T cells. Cell Stem Cell, 7, 11-14, (2010).
- McCabe, N., Cerone, M. A., Ohishi, T., Seimiya, H., Lord, C. J. and Ashworth, A. Targeting Tankyrase 1 as a therapeutic strategy for BRCA-associated cancer. Oncogene, 28, 1465-1470, (2009).
- Muramatsu, Y., Tahara, H., Ono, T., Tsuruo, T. and Seimiya, H. Telomere elongation by a mutant tankyrase 1 without TRF1 poly(ADP-ribosyl)ation. Exp Cell Res, 314, 1115-1124, (2008).
- Muramatsu, Y., Ohishi, T., Sakamoto, M., Tsuruo, T. and Seimiya, H. Cross-species difference in telomeric function of tankyrase 1. Cancer Sci, 98, 850-857, (2007).
- Seimiya, H., Muramatsu, Y., Ohishi, T. and Tsuruo, T. Tankyrase 1 as a target for telomere-directed molecular cancer therapeutics. Cancer Cell, 7, 25-37, (2005).
- Seimiya, H., Muramatsu, Y., Smith, S. and Tsuruo, T. Functional subdomain in the ankyrin domain of tankyrase 1 required for poly(ADP-ribosyl)ation of TRF1 and telomere elongation. Mol Cell Biol, 24, 1944-1955, (2004).
- Seimiya, H. and Smith, S. The telomeric poly(ADP-ribose) polymerase, tankyrase 1, contains multiple binding sites for telomeric repeat binding factor 1 (TRF1) and a novel acceptor, 182-kDa tankyrase-binding protein (TAB182). J Biol Chem, 277, 14116-14126, (2002).











