
ユビキチンホメオスタシスの制御機構
 |
研究代表者 木村洋子 (財)東京都医学総合研究所 蛋白質代謝研究室 http://www.rinshoken.or.jp/MO/ |
【研究概要】
ユビキチンは細胞内に豊富に存在するタンパク質であるが、細胞の環境や状態に応じて激しく変動し、適切な量に厳格に調節されている。実際、ユビキチンの不足は、マウスでは不妊、肥満、神経変性変異を起こし、出芽酵母はストレス感受性になり胞子形成能を失う。一方、ユビキチンは過剰にあっても、出芽酵母では重金属に対して感受性になり、細胞に悪影響を与える。従ってユビキチン量が過不足なく調節されていること(ユビキチンホメオスタシス)は、生命活動の維持に重要である。これまで細胞内のユビキチンホメオスタシスについての研究は、ユビキチン遺伝子の転写調節などが報告されているが、ほとんどされていなかった。最近私達は、出芽酵母において細胞内のユビキチンレベルが、脱ユビキチン化酵素Doa4とそのインヒビターRfu1によって制御されているという新たな仕組みを発見した(Cell, 2009)。さらに、熱ストレス時には、Doa4が増えRfu1が減り、この両者のバランスが単量体ユビキチン量の産生に重要な役割を担っていることも明らかにした。さらに、平常時に存在するフリーのユビキチン鎖が熱ショック時に消失することから、フリーのユビキチン鎖は過剰なユビキチンを蓄えるユビキチンのリザーバー型ではないかというモデルも提唱した。しかし、ユビキチン修飾の多様性、即ち鎖状型、タンパク質に結合した型などさまざまな動態をとるユニークな特性、さらにユビキチンをコードする遺伝子の特殊構造などを考えると、ユビキチンのホメオスタシスを維持する機構は、未知の点が非常に多く、その究明は生命活動を理解するために必須である。そこで、本研究では、これまでに独自に展開してきた研究を出発点に、ユビキチンホメオスタシスの全貌に迫りたい。例えば、Doa4, Rfu1をはじめ、細胞内の単量体ユビキチンの量に影響を与える因子の多くがエンドソームに局在することから、ユビキチンの局在とユビキチンホメオスタシスの関係も調べる予定である。また、ユビキチンシステムに関係の深いAAA+ ATPase VCP/p97/Cdc48の解析も進め、ユビキチンの動態、局在変化や、ストレスに対する細胞の生体防御機構の仕組みも解明したい。
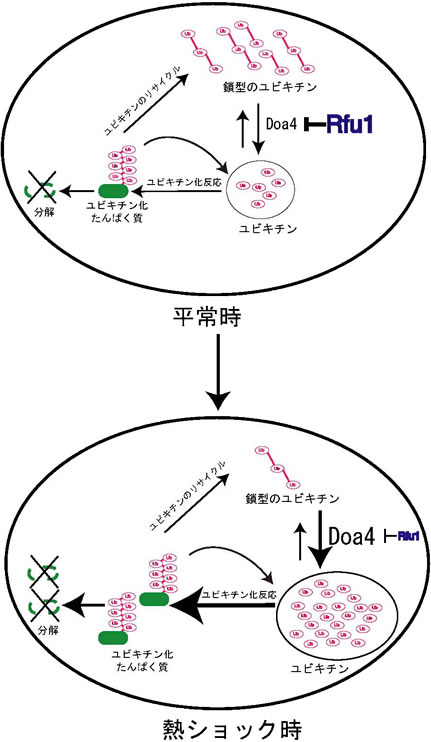
(図の説明)平常時においては、過剰なユビキチンはフリーのユビキチン鎖として細胞内に存在していると考えられる。Doa4はフリーのユビキチン鎖を単量体ユビキチンに変換する働きがあり、Rfu1はその働きを阻害している。熱ショック時には、Doa4の量が増えRfu1の量が減り、フリーのユビキチン鎖がすみやかに単量体ユビキチンに変えられ、ユビキチン化反応が進行する。
【参考文献】
- Kimura Y and Tanaka K. Regulatory mechanisms involved in the control of ubiquitin homeostasis. J. Biochem. 147:793-798. 2010
- Kimura Y, Yashiroda H, Kudo T, Koitabashi S, Murata S, Kakizuka A and Tanaka K. An inhibitor of deubiquitinating enzyme regulates ubiquitin homeostasis. Cell 137:549-559. 2009
- Mori-Konya C, Kato N, Maeda R, Yasuda K, Higashimae N, Noguchi M, Koike M, Kimura Y, Ohizumi H, Hori S, and Kakizuka A. p97/valosin-containing protein (VCP) is highly modulated by phosphorylation and acetylation. Gene Cells 14:483-497. 2009
- Kimura Y, Lee WX, and Littleton JT. Therapeutic prospects for the prevention of neurodegeneration in Huntington’s disease and the polyglutamine repeat disorders. Mini Rev Med Chem. 7(1): 99-106. 2007
- Noguchi M, Tanaka T, Kimura Y, A, Murakami K. Koike M, Ohizumi H, Hori S, and Kakizuka A. ATPase activity of VCP is regulated by oxidative modification of the evolutionally conserved cysteine 522 residue in walker A motif. J Biol. Chem. 280(50):41332-41. 2005
- Kimura Y, Koitabashi S, Kakizuka A, Fujita T. The role of pre-exisiting aggregates in Hsp104-dependnent polyglutamine aggregate formation and epigenetic change of yeast prions. Genes Cells 9:685-696. 2004











