
チェックポイントキナーゼ1(Chk1)を介したシグナル伝達機構と疾患
 |
研究代表者 後藤英仁(ごとう ひでまさ) 愛知県がんセンター研究所・発がん制御研究部 http://www.pref.aichi.jp/cancer-center/400/420/421/421-08.html |
【研究概要】
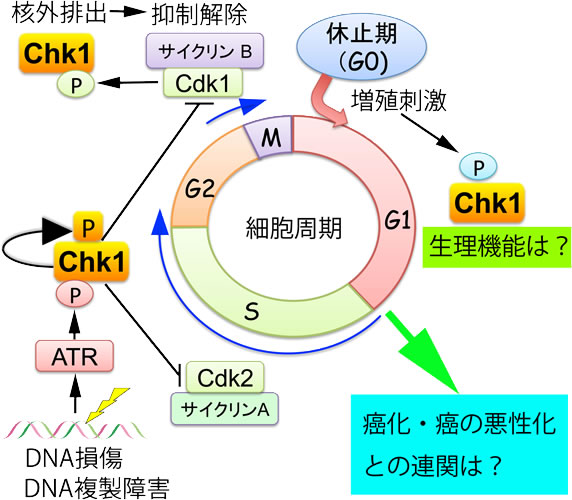
細胞には、紫外線 (UV) や放射線などのDNAの損傷が生じた際やDNAの複製阻止が引き起こされた際に、そのDNA異常を監視し修復するチェックポイント機構が存在する。このチェックポイント機構に破綻が生ずると、正常細胞が癌化したり、癌細胞が悪性化したりすると考えられている。チェックポイント機構の中心分子として、ATR(ATM- and Rad3-related)からチェックポイントキナーゼ1 (Chk1)に至るリン酸化酵素(キナーゼ)カスケイドがその中心的な役割を担っている。種々のDNA損傷によって活性化されたATRは、Chk1のSer317およびSer345をリン酸化する。このリン酸化修飾を契機に、Chk1は活性化し、(Cdc25Aをリン酸化することによって)Cdc25Aのユビキチン化反応(分解反応)を誘導する。このCdc25Aの分解により、細胞周期の進行エンジンであるサイクリン依存性キナーゼ(Cdk)が活性化しないため、細胞周期の進行が停止する。しかしながら、ATRによるChk1の活性化からCdc25Aの分解に至る経路の詳細については、不明な点が多かった。
我々は、ATRによって活性化されたChk1がSer296の自己リン酸化反応を契機に14-3-3ガンマを介してCdc25Aと複合体を形成すること、および、この複合体形成がCdc25Aのリン酸化および分解反応に重要であることを示し、上記の不明であったシグナル伝達経路の詳細を明らかにした(Kasahara K., et al. EMBO J., 2010)。また、分裂期への移行期において、Chk1のSer286およびSer301がCdk1によってリン酸化されること、このリン酸化修飾によりChk1が核から細胞質に移行すること、このChk1の核外移行によって核内でのCdk1のさらなる活性化が引き起こされること、および、このCdk1とChk1の間のポジティブフィードバック経路によって細胞が分裂期へ円滑に進行できることを明らかにした(Enomoto M., et al. J. Biol. Chem., 2009; Matsuyama M., et al. J. Cell Sci., 2011)。つまり、我々は、これまでの研究で、Chk1が、ATR以外のキナーゼによってリン酸化修飾を受けることで、その機能を大きく変化させていることを明らかにしてきた。
今後、これらの研究を発展させ、1)Chk1の新たなリン酸化修飾による機能変化(特に、増殖因子刺激によって引き起こされるChk1のSer280のリン酸化修飾の生理的意義)、2)これまでに知られていないChk1の生理機能の2つに焦点を当てて、研究を遂行していく。また、これら研究で得た知見をもとに、実際の癌組織でどのようなChk1の制御異常が認められるのかについても検討していく。これらの解析を通して、Chk1が癌治療の分子標的となりうる可能性を探求していきたい。
【参考文献】
- *Matsuyama M., *Goto H., *Kasahara K., Kawakami Y., Nakanishi M., Kiyono T., Goshima N., and Inagaki M.: Nuclear Chk1 prevents premature mitotic entry. J. Cell Sci. 124: 2113-2119, 2011. (*These authors contributed equally.)
- Kasahara K., Goto H., Enomoto M., Tomono Y., Kiyono T., and Inagaki, M.: 14-3-3γ mediates Cdc25A proteolysis to block premature mitotic entry after DNA damage. EMBO J. 29: 2802-2812, 2010.
- Enomoto M., Goto H., Tomono Y., Kasahara K., Tsujimura K., Kiyono T., and Inagaki M.: Novel positive feedback loop between Cdk1 and Chk1 in the nucleus during G2/M transition. J. Biol. Chem. 284: 34223-34230, 2009.
- Ikegami Y., Goto H., Kiyono T., Enomoto M., Kasahara K., Tomono Y., Tozawa K., Morita A., Kohri K., and Inagaki M.: Chk1 phosphorylation at Ser286 and Ser301 occurs with both stalled DNA replication and damage checkpoint stimulation. Biochem. Biophys. Res. Commun. 377: 1227-1231, 2008.
- Goto H. and Inagaki M.: Production of a site- and phosphorylation state-specific antibody. Nat. Protoc. 2: 2574-2581, 2007.
- Shiromizu T., Goto H., Tomono Y., Bartek J., Totsukawa G., Inoko A., Nakanishi M., Matsumura F., and Inagaki M.: Regulation of mitotic function of Chk1 through phosphorylation at novel sites by cyclin-dependent kinase 1 (Cdk1). Genes Cells 11: 477-485, 2006.
- Goto H., Kiyono T., Tomono Y., Kawajiri A., Urano T., Furukawa K., Nigg E.A., and Inagaki M.: Complex formation of Plk1 and INCENP required for Metaphase-anaphse transition. Nat. Cell Biol. 8: 180-187, 2006.
- Yamaguchi T., Goto H., Yokoyama T., Silljé H., Hanisch A., Uldschmid A., Takai Y., Oguri T., Nigg E.A., and Inagaki M.: Phosphorylation by Cdk1 induces Plk1-mediated vimentin phosphorylation during mitosis. J. Cell Biol. 171: 431-436, 2005.











