
OGFOD1による翻訳開始因子キナーゼの水酸化
 |
研究代表者 五十嵐城太郎 福島県立医科大学医学部自然科学講座(生物学) http://www.fmu.ac.jp/cms/biol2000/ |
【研究概要】
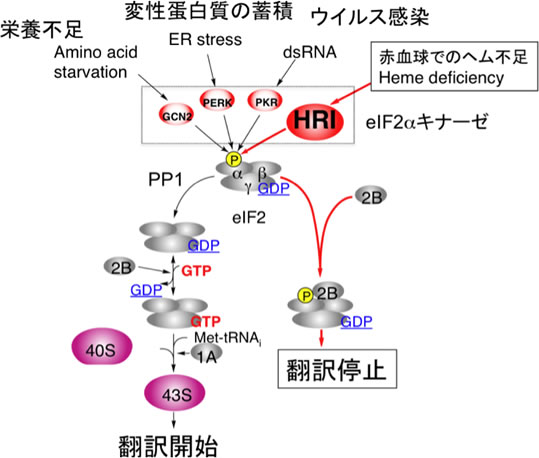
真核細胞は、鉄不足、低酸素によるストレスを受けたとき、タンパク質合成が低下することが知られている。本研究では、この現象に関与する翻訳開始因子キナーゼHRIを対象として、新規の鉄・酸素センサータンパク質OGFOD1による活性調節機構を解明する。
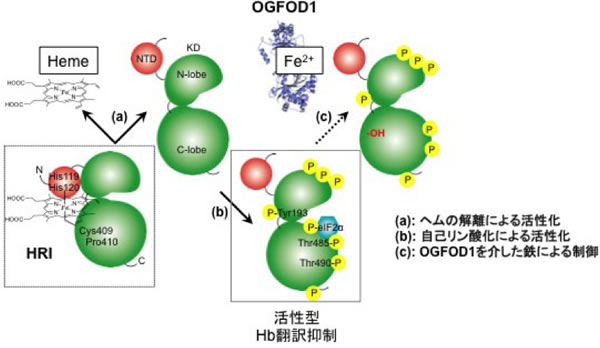
HRIはヘム濃度を感知するヘムセンサータンパク質であり、赤血球においてヘムとヘモグロビンの量比を一定に保つため必要不可欠な分子である。一方、OGFOD1は鉄、酸素、2-オキソグルタル酸を補因子とするプロリン水酸化酵素と予測されているものの、その基質、反応等は不明なままである。本研究では、OGFOD1によって認識された鉄不足・低酸素シグナルが、HRIの修飾を通じて、どのように制御されるのかを解明することを課題とする。また、HRIのX線結晶構造解析にも挑戦し、タンパク質の修飾による構造変化を立体構造から捉えたい。
申請者らはHRIについて、一酸化窒素による活性化、ヘム結合による不活性化、自己リン酸化による活性化など、一連の活性制御機構について分子レベルでの研究を行ってきた(文献2, 4-6)。
鉄・酸素センサーとしてのOGFOD1を介して翻訳開始因子キナーゼ(HRI)が修飾されることによる生理的役割、構造機能相関を解明するために、具体的には以下の3つのサブ研究テーマを遂行する。
- OGFOD1によるプロリン水酸化反応の解析:OGFOD1遺伝子を取得し、組換えOGFOD1を発現、精製する。得られた標品を用いて、プロリン水酸化反応について構造機能解析を行う。
- OGFOD1によるHRIの制御機構の解明:OGFOD1の基質として、HRIを用いたときの活性を測定し、プロリン水酸化部位の同定を行う。同時に、他のOGFOD1の基質の探索も行う。また、培養細胞を用いて、鉄・低酸素ストレスによるOGFOD1、HRIのmRNA量、タンパク質量を定量的に評価する。
- HRIの立体構造解析による分子機構の解明:高純度に精製したタンパク質を用いてHRIの結晶化スクリーニングを行う。構造解析に使用できる結晶が得られた後、結晶の評価を行い、放射光施設(高エネルギー加速器研究機構)において高分解能のデータを収集し、構造解析を進める。
【参考文献】
- Igarashi, J., Kobayashi, K. and Matsuoka, A. "A hydrogen-bonding network formed by the B10-E7-E11 residues of a truncated hemoglobin from Tetrahymena pyriformis is critical for stability of bound oxygen and nitric oxide detoxification." J. Biol. Inorg. Chem. 16, 599-609 (2011)
- Igarashi, J., Sasaki, T., Kobayashi, N., Yoshioka, S., Matsushita, M. and Shimizu, T. "Autophosphorylation of heme-regulated eukaryotic initiation factor 2α kinase, HRI, and the role of the modification in catalysis" FEBS J. 278, 918-928 (2011)
- Igarashi, J., Li, H., Jamal, J., Ji, H., Fang, J., Lawton, G., Silverman, R. B. and Poulos, T. L. "Crystal structures of constitutive nitric oxide synthases in complex with de novo designed inhibitors" J. Med. Chem. 52, 2060-2066 (2009)
- Igarashi, J., Murase, M., Iizuka, A., Pichierri, F., Martinkova, M. and Shimizu, T. "Elucidation of the heme-binding site of heme-regulated eIF2α kinase (HRI) and the role of the regulatory motif in heme sensing by spectroscopic and catalytic studies of mutant proteins" J. Biol. Chem. 283, 18782-18791 (2008)
- Miksanova, M., Igarashi, J., Minami, M., Sagami, I., Yamauchi, S., Kurokawa, H. and Shimizu, T. "Characterization of heme-regulated eIF2α kinase: roles of the N-terminal domain in the oligomeric state, heme binding, catalysis, and inhibition" Biochemistry 45, 9894-9905 (2006)
- Igarashi, J., Sato, A., Kitagawa, T., Yoshimura, T., Yamauchi, S., Sagami, I. and Shimizu, T. "Activation of heme-regulated eukaryotic initiation factor 2α kinase by nitric oxide is induced by the formation of a five-coordinate NO-heme complex: optical absorption, electron spin resonance, and resonance raman spectral studies" J. Biol. Chem. 279, 15752-15762 (2004)











