
慢性炎症病態を制御するシグナル依存性エピゲノム制御メカニズムの解析
 |
研究代表者 沢津橋 俊 群馬大学・生体調節研究所・核内情報制御分野 http://kakunai.dept.showa.gunma-u.ac.jp/kitagawa/ |
【研究概要】
本研究は、栄養情報という一種の「エネルギー代謝シグナル」と「炎症シグナル」からのシグナル情報が集積する受容因子・作動因子としてグルココルチコイドレセプター(GR)を中心とした抗炎症性転写制御の分子メカニズム解析を基幹とし、慢性炎症病態の究明と将来的な治療戦略への分子基盤構築を目指す。
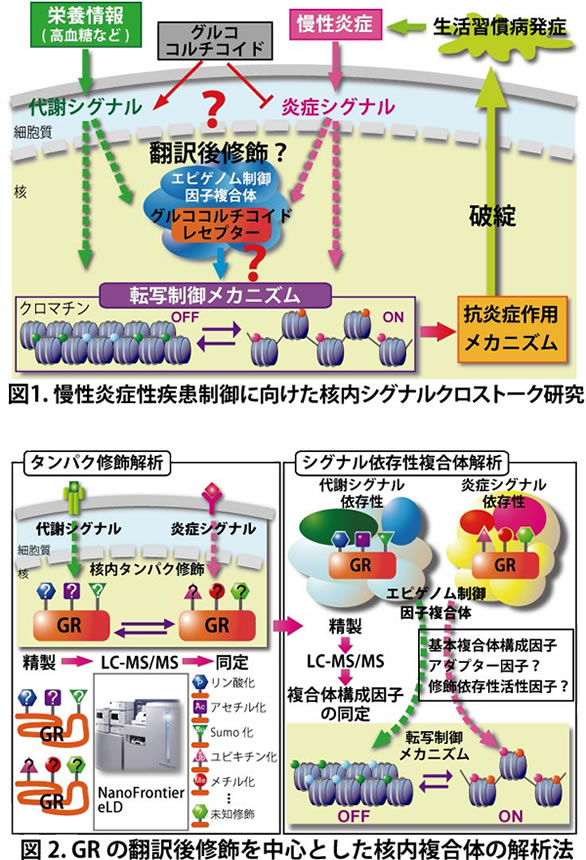
生活習慣病の基盤病態となる慢性炎症性疾患では長期に炎症状態が持続し、組織機能障害が引き起こされる。さらに、糖尿病でみられる慢性的な高血糖状態はマクロファージからの炎症性サイトカインの産生亢進を引き起こし、炎症の遷延につながるものと理解される。しかしながら、高血糖状態が慢性炎症病態の発症・悪化に関与する分子メカニズムの全容は明らかにされていない。我々が研究対象とするグルココルチコイドレセプター(GR)は、「糖代謝恒常性」と「炎症」を制御する代表的な核内受容体の一つである。そのリガンドであるグルココルチコイドは血糖値維持に働くホルモンであると同時に、臨床においては強力な抗炎症薬として広く用いられているが、副作用の問題点がある。このようなエネルギー代謝と炎症の両者を司る細胞内シグナルは、様々なシグナル経路でクロストークする可能性が考えられるが、核内におけるクロストークは「エピゲノム制御因子」を介した形をとることが近年明らかになりつつある(図1)。しかしながら、「エネルギー代謝シグナル」と「炎症シグナル」のスイッチングを制御する分子メカニズムに関しては未だ不明な点が多い。古くからグルココルチコイドによる抗炎症作用メカニズムは、GRによる炎症性転写因子AP-1やNF-κBに対するリガンド依存性の転写抑制であることが知られている。近年、我々はGRがAP-1構成因子c-JunのSUMO化を制御する複合体として機能し、このSUMO化修飾はエピゲノム制御因子のひとつであるヒストンメチル化酵素EZH2をリクルートするトリガーとなることを見出し、エピゲノム制御因子を介した抗炎症メカニズムを明らかにしつつある。
現在、我々はタンパク質の翻訳後修飾をトリガーとした修飾依存性複合体活性・複合体構成のスイッチング制御が重要であると予想し、生化学的手法によるタンパク質精製からLC-MS/MS解析を用いて、GRの翻訳後修飾パターンの同定とエピゲノム制御因子複合体の探索を試みている(図2)。
【参考文献】
- Sawatsubashi, S., Murata, T., Lim, J., Fujiki R., Ito, S., Suzuki, E., Tanabe, M., Zhao, Y., Kimura, S., Fujiyama, S., Ueda, T., Umetsu D., Ito T., Takeyama, K., and Kato, S. (2010): Histone chaperone DEK coactivates a nuclear receptor, Genes & Development 24, 159-170.
- 2. Ochiai, E., Kitagawa, H., Takada I., Fujiyama S., Sawatsubashi S., Kim M., Mezaki Y., Tshuushima Y., Takagi K., Yamaoka K., Kato S., Kamimura T. (2010): CDP/Cut is an Osteoblastic Co-activator of the Vitamin D receptor (VDR), J Bone Miner Res 25, 1157-1166.
- Zhao, Y., Takeyama, K., Sawatsubashi, S., Ito, S., Suzuki, E., Yamagata, K., Tanabe, M., Kimura, S., Fujiyama, S., Ueda, T., Murata, T., Matsukawa, H., Shirode, Y., Kouzmenko, A. P., Li, F., Tabata, T., and Kato, S. (2009): Corepressive action of CBP on androgen receptor transactivation in pericentric heterochromatin in a Drosophila experimental model system, Mol Cell Biol 29, 1017-1034.
- Suzuki, E., Zhao, Y., Ito, S., Sawatsubashi, S., Murata, T., Furutani, T., Shirode, Y., Yamagata, K., Tanabe, M., Kimura, S., Ueda, T., Fujiyama, S., Lim, J., Matsukawa, H., Kouzmenko, A. P., Aigaki, T., Tabata, T., Takeyama, K., and Kato, S. (2009): Aberrant E2F activation by polyglutamine expansion of androgen receptor in SBMA neurotoxicity, Proc Natl Acad Sci U S A 106, 3818-3822.
- Kouzu-Fujita, M., Mezaki, Y., Sawatsubashi, S., Matsumoto, T., Yamaoka, I., Yano, T., Taketani, Y., Kitagawa, H., and Kato, S. (2009): Coactivation of estrogen receptor beta by gonadotropin- induced cofactor GIOT-4, Mol Cell Biol 29, 83-92.
- Fujiyama-Nakamura, S., Ito, S., Sawatsubashi, S. Yamauchi, Y., Suzuki, E., Tanabe, M., Kimura, S., Murata, T., Isobe, T., Takeyama, K., and Kato, S. (2009): BTB protein, dKLHL18/CG3571, serves as an adaptor subunit for a dCul3 ubiquitin ligase complex, Genes Cells 14, 965-973.
- Zhao, Y., Lang, G., Ito, S., Bonnet, J., Metzger, E., Sawatsubashi, S., Suzuki, E., Le Guezennec, X., Stunnenberg, H. G., Krasnov, A., Georgieva, S. G., Schule, R., Takeyama, K., Kato, S., Tora, L., and Devys, D. (2008): A TFTC/STAGA module mediates histone H2A and H2B deubiquitination, coactivates nuclear receptors, and counteracts heterochromatin silencing, Mol Cell 29, 92-101.
- Tanabe, M., Kouzmenko, A. P., Ito, S., Sawatsubashi, S., Suzuki, E., Fujiyama, S., Yamagata, K., Zhao, Y., Kimura, S., Ueda, T., Murata, T., Matsukawa, H., Takeyama, K., and Kato, S. (2008): Activation of facultatively silenced Drosophila loci associates with increased acetylation of histone H2AvD, Genes Cells 13, 1279-1288.
- Murata, T., Suzuki, E., Ito, S., Sawatsubashi, S., Zhao, Y., Yamagata, K., Tanabe, M., Fujiyama, S., Kimura, S., Ueda, T., Matsukawa, H., Kouzmenko, A., Furutani, T., Kuranaga, E., Miura, M., Takeyama, K., and Kato, S. (2008): RNA-binding protein hoip accelerates polyQ-induced neurodegeneration in Drosophila, Biosci Biotechnol Biochem 72, 2255-2261.
- Kimura, S., Sawatsubashi, S., Ito, S., Kouzmenko, A., Suzuki, E., Zhao, Y., Yamagata, K., Tanabe, M., Ueda, T., Fujiyama, S., Murata, T., Matsukawa, H., Takeyama, K., Yaegashi, N., and Kato, S. (2008): Drosophila arginine methyltransferase 1 (DART1) is an ecdysone receptor co-repressor, Biochem Biophys Res Commun 371, 889-893.











