
筋原線維形成のシグナル伝達機構の包括的解明とその破綻による筋疾患・心筋症
 |
研究代表者 遠藤 剛 千葉大学大学院理学研究科 http://life.s.chiba-u.jp/endo/hp/ |
【研究概要】
骨格筋や心筋の収縮は,体の各部の動きだけでなく呼吸,嚥下や心臓の拍動を担っている.そのため,筋疾患や心筋症は生命に直結する重篤な疾患となりうる.筋収縮を担う筋原線維の形成異常は,これらの筋疾患や心筋症につながる.しかし筋原線維形成の分子機構やシグナル伝達機構についてはこれまでほとんど不明であった.
私たちは,インスリン様増殖因子1 (IGF-1) による骨格筋の筋成熟や筋肥大の過程において,筋原線維形成が起こることに着目し,次のような機構で骨格筋筋原線維のアクチン線維が形成されることを解明した(図A).IGF-1刺激のないマウスの筋原線維では,GSK-3がnebulin (Neb) のC末端(Z帯に局在)をリン酸化する.リン酸化されたNebのC末端にはN-WASPが結合できないため,アクチン線維が形成されず,筋萎縮が起こる.しかしIGF-1刺激があると,PI3K–Aktシグナリングが活性化され,GSK-3がリン酸化されて不活性化する.するとNebのC末端はリン酸化されないため,NebのSH3ドメインにN-WASPのPro-rich領域が結合し,N-WASPはZ帯に局在化する.Nebのアクチン結合モジュールとN-WASPのWH2ドメインとが共同してアクチン重合核を形成し,アクチンはZ帯からNeb(長さ1μm)のモジュールに沿って重合して,1μmの枝分かれのない直線状のアクチン線維が形成される.このアクチン線維形成が,筋原線維形成,さらに筋再生における筋成熟や筋肥大に必要である.
一方,心筋にはNebは存在せず,代わりに長さわずか0.15μmのnebulette (Nebt) が存在する.それにもかかわらず心筋のアクチン線維も骨格筋のアクチン線維と同様に長さ1μmである.そこで本研究では,心筋筋原線維のアクチン線維形成のシグナル伝達機構を,IGF-1シグナリングによって制御されるリン酸化とポリユビキチン化に着目して明らかにする(図A).これにより骨格筋と心筋の筋原線維形成のシグナル伝達機構を包括的に解明する.またこのシグナル伝達が心肥大にも働いていることを明らかにする.NebのC末端側の欠損を引き起こすNEB遺伝子の突然変異は,重篤な先天性筋疾患ネマリンミオパチーの原因となる.またNEBT遺伝子の突然変異が拡張型心筋症の原因の一つであることが示された.そこで本研究ではさらに,NebとN-WASPによるアクチン線維形成の不全が,ネマリンミオパチーの発症に通ずることを明らかにする.またNebtとN-WASPによるアクチン線維形成の不全が,心機能不全と拡張型心筋症につながることを明らかにする(図A).
また私たちは,Ras–ERKカスケードを構成するA-RafのスプライシングアイソフォームDA-Rafを発見した.DA-RafはRas結合ドメインをもっているが,キナーゼドメインを欠損している.そのためDA-RafはRas–ERKカスケードのドミナントネガティブアンタゴニストとして機能し,発がん性Rasによる細胞のがん化とマウスにおける腫瘍形成を抑制した(図B).またRas–ERKカスケードは筋細胞分化を阻害するため,DA-RafはRas–ERKカスケードを抑制することにより,筋細胞分化において必須の役割を担っていた.さらにDA-Rafは肺胞形成にも不可欠であった.そこで本研究では,DA-Rafによる肺胞形成の分子機構とシグナル伝達機構を解明する.さらにDA-Rafの機能異常が肺線維症や肺気腫につながることを明らかにする(図B).
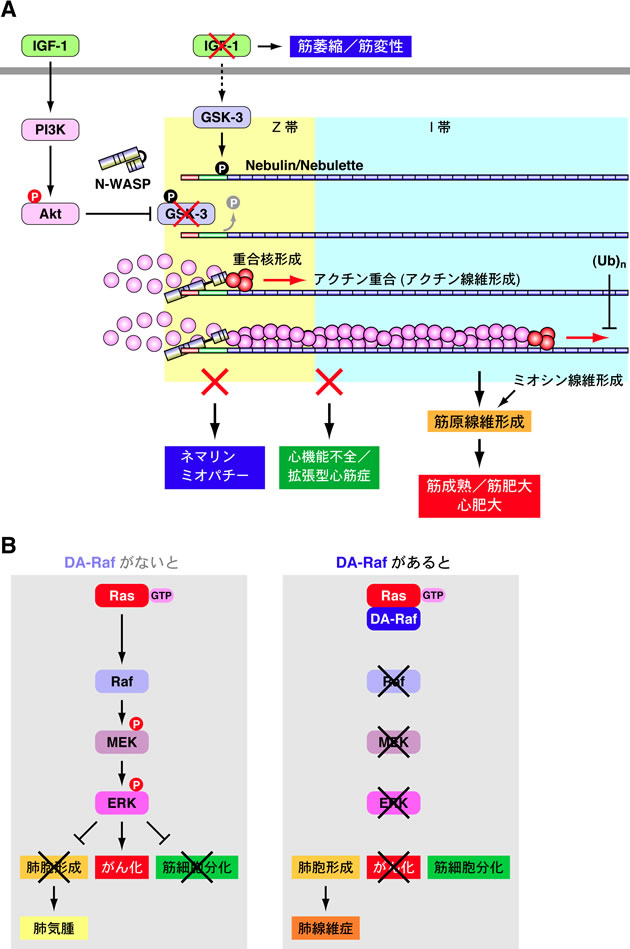
(A) IGF-1シグナリングによる筋原線維のアクチン線維形成のシグナル伝達機構と分子機構,およびその破綻による筋疾患と心筋症
(B) DA-RafによるRas-ERKカスケードの阻害とそれによるがん化抑制,筋細胞分化,および肺胞形成
【参考文献】
- Koizumi, K., Takano, K., Kanayasu, A., Watanabe-Takano, H., Tokuda, E., Abe, T., Watanabe, N., Takenawa, T., and Endo, T.: RhoD activated by fibroblast growth factor induces cytoneme-like cellular protrusions through mDia3C. Mol. Biol. Cell 23, 4647–4661 (2012).
- Takano, K., Watanabe-Takano, H., Suetsugu, S., Kurita, S., Tsujita, K., Kimura, S., Karatsu, T., Takenawa, T., and Endo, T.: Nebulin and N-WASP cooperate to cause IGF-1-induced sarcomeric actin filament formation. Science 330, 1536–1540 (2010).
- Watanabe-Takano, H., Takano, K., Keduka, E., and Endo, T.: M-Ras is activated by bone morphogenetic protein-2 and participates in osteoblastic determination, differentiation, and transdifferentiation. Exp. Cell Res. 316, 477–490 (2010).
- Yokoyama, T., Takano, K., Yoshida, A., Katada, F., Sun, P., Takenawa, T., Andoh, T., and Endo, T.: DA-Raf1, a competent intrinsic dominant-negative antagonist of the Ras–ERK pathway, is required for myogenic differentiation. J. Cell Biol. 177, 781–793 (2007).
- Endo, T.: Stem cells and plasticity of skeletal muscle cell differentiation: potential application to cell therapy for degenerative muscular diseases. Regen. Med. 2, 243–265 (2007).
- Sun, P., Watanabe, H., Takano, K., Yokoyama, T., Fujisawa, J., and Endo, T.: Sustained activation of M-Ras induced by nerve growth factor is essential for neuronal differentiation of PC12 cells. Genes Cells 11, 1097–1113 (2006).
- Kawamura, K., Takano, K., Suetsugu, S., Kurisu, S., Yamazaki, D., Miki, H., Takenawa, T., and Endo, T.: N-WASP and WAVE2 acting downstream of phosphatidylinositol 3-kinase are required for myogenic cell migration induced by hepatocyte growth factor. J. Biol. Chem. 279, 54862–54872 (2004).
- Abe, T., Takano, K., Suzuki, A., Shimada, Y., Inagaki, M., Sato, N., Obinata, T., and Endo, T.: Myocyte differentiation generates nuclear invaginations traversed by myofibrils associating with sarcomeric protein mRNAs. J. Cell Sci. 117, 6523–6534 (2004).
- Sun, P., Yamamoto, H., Suetsugu, S., Miki, H., Takenawa, T., and Endo, T.: Small GTPase Rah/Rab34 is associated with membrane ruffles and macropinosomes and promotes macropinosome formation. J. Biol. Chem. 278, 4063–4071 (2003).
- Abe, T., Kato, M., Miki, H., Takenawa, T., and Endo, T.: Small GTPase Tc10 and its homologue RhoT induce N-WASP-mediated long process formation and neurite outgrowth. J. Cell Sci. 116, 155–168 (2003).











