
増殖因子および受容体の蛋白質プロセッシングによる制御システムの解析
 |
研究代表者 越川直彦 東京大学医科学研究所・腫瘍細胞社会学分野 http://www.ims.u-tokyo.ac.jp/cancercell/ |
【研究概要】
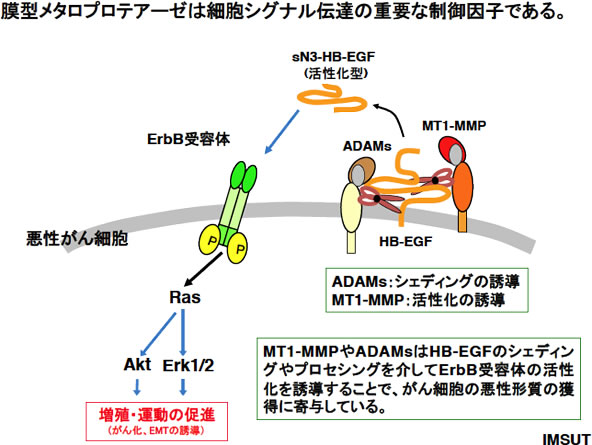
蛋白質は翻訳後に修飾を受けて本来の機能を獲得することから、蛋白質の翻訳後修飾は細胞機能の制御に極めて重要な役割を果たす。細胞シグナル蛋白質のリン酸化と脱リン酸化は細胞内シグナルの制御に重要な翻訳後修飾の代表例である。また最近では、ユビキチン化やSUMO化による蛋白質の多様な制御システムが注目を浴びている。しかし、様々なタンパク質の翻訳後修飾が着目される中で、プロテアーゼによる蛋白質プロセッシングよる制御の重要性は、意外と見落とされており、当該新学術領域においても計画研究には含まれていない。細胞内蛋白質分解系は独自の研究領域として取り扱われているが、細胞外プロテアーゼは細胞外基質(ECM)の単なる分解の手段として見なされており、そのプロセシングが蛋白質の機能変換に寄与することはあまり注目されていない。これまでに、種々の細胞外プロテアーゼが細胞膜近傍の蛋白質のプロセシングを介した細胞機能変換に重要な役割を果たすことが見出されている。例として、メタロプロテアーゼあるADAM-17はproTNF-αの活性化やNotchリガンドの細胞膜上のプロセシングによるNotchシグナルの活性化に重要な役割を担う。また、申請者は悪性がん由来の腫瘍トリプシンがG 蛋白質共役受容体のPAR-2 を活性化すること(JBC 2001)、がん細胞の悪性化に重要な膜型マトリックスメタロプロテアーゼ1(MT1-MMP)がラミニン5γ2 をプロセシングすることで、遊離したEGF様断片がパラクライン、オートクラインにEGF 受容体を活性化し、がん細胞の悪性化の亢進に重要な役割を果たすことを見出している(JCB, 2001,2003)。これら知見は細胞外プロテアーゼによる蛋白質分解の重要性を強く示唆している。そこで本研究では、先行研究で見出している細胞内シグナルの起点となる細胞膜上の増殖関連蛋白質である増殖因子とその受容体であるHB-EGFやEphA2に着目しながら、これらの蛋白質のプロセッシングによるシグナル制御を明らかにすることにより当該研究領域に目指している疾患とのかかわりを明らかにすることを目的とする。そして、細胞外プロテアーゼによるプロセシングと言う翻訳後修飾の異常が疾病(がん)の発症・進展のトリガーとなりうる可能性を検証する。以上から、翻訳後修飾としての細胞外プロテアーゼによる蛋白質のプロセシングが細胞機能制御に重要な役割を果たすことを明確にする。
【参考文献】
- Koshikawa N, Mizushima H, Minegishi T, et al. Proteolytic activation of heparin-binding EGF-like growth factor by membrane-type matrix metalloproteinase-1 in ovarian carcinoma cells. Cancer Sci. 2011; 102: 111-6.
- Hoshino D, Koshikawa N, Seiki M. A p27(kip1)-binding protein, p27RF-Rho, promotes cancer metastasis via activation of RhoA and RhoC. J Biol Chem. 2011; 286: 3139-48.
- Nagano M, Hoshino D, Sakamoto T, Kawasaki N, Koshikawa N, Seiki M. ZF21 protein regulates cell adhesion and motility. J Biol Chem. 2010; 285: 21013-22.
- Koshikawa N, Mizushima H, Minegishi T, Iwamoto R, Mekada E, Seiki M. Membrane type 1-matrix metalloproteinase cleaves off the NH2-terminal portion of heparin-binding epidermal growth factor and converts it into a heparin-independent growth factor. Cancer Res. 2010; 70: 6093-103.
- Tomari T, Koshikawa N, Uematsu T, et al. High throughput analysis of proteins associating with a proinvasive MT1-MMP in human malignant melanoma A375 cells. Cancer Sci. 2009; 100: 1284-90.











