
TRIMファミリーによる基質蛋白修飾を介した癌と感染症での発症制御システムの解明
 |
研究代表者 浦野友彦 東京大学22世紀医療センター抗加齢医学講座 |
【研究概要】
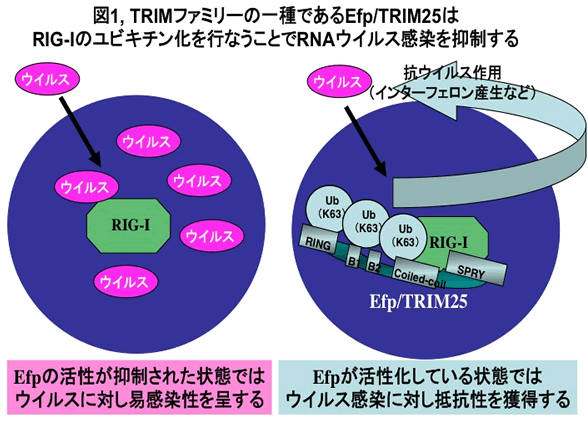
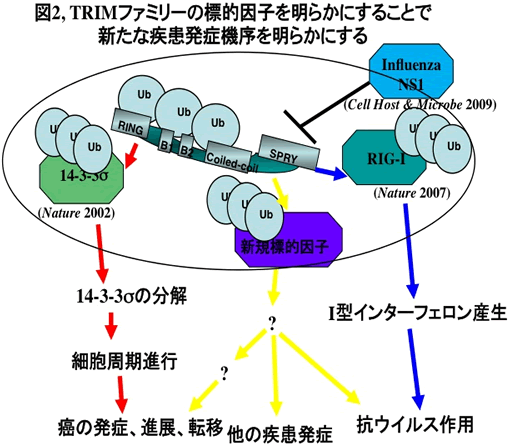
性ホルモンやインターフェロンは癌やウイルス感染症の発症に関与することが知られている。研究代表者らはEfp(別名:TRIM25)がユビキチン化蛋白修飾活性を有する酵素であり、その発現はエストロゲンにより誘導されることを発見した(Nature 417, 871-875, 2002)。さらにEfpの酵素活性亢進は、細胞周期進行やインターフェロン産生を活性化し、乳癌の発症やウイルス感染防御を誘導すること(Nature 446, 916-920, 2007)を世界に先駆けて報告してきた。その中で、Efpはウイルス感染からNF-κBシグナルを活性化する因子であるRIG-Iの蛋白修飾酵素として、そのシグナルの活性化に必須な因子であることを研究代表者らは見出した(図1)。さらにEfpによるウイルス感染防御機構は、インフルエンザAウイルスの構成蛋白であるNS1により破綻をきたすことでインフルエンザウイルス感染症が発症することも見出した(Cell Host Microbe 5, 439-449, 2009)。またEfp蛋白はユビキチン様蛋白であるISG15による蛋白修飾によりその機能を制御していることも研究代表者らは見出した(Biochem Biophys Res Commun 351, 540-546, 2006)。EfpはTRIMファミリー蛋白群に分類される。同ファミリーは現在までにヒトでは60種類程度知られ、2002年における研究代表者らの報告以後には、Efp以外のTRIM蛋白もユビキチン化ならびに類似蛋白修飾であるISG15化活性を有することが報告されている。また、Efp以外のTRIMファミリー蛋白も、性ホルモンやサイトカインといった疾患発症に関わる液性因子によりその発現が誘導されることを研究代表者らは見出している。さらに細胞の生存をはじめとする様々なシグナルの根幹をなすNF-κBシグナルを複数のTRIMファミリー蛋白が活性化し、複数のTRIMファミリーノックアウトマウス由来の細胞においてはNF-κBシグナルが抑制されることを見出している。以上より、研究代表者らはEfpならびにTRIMファミリー蛋白の研究で得られた知見から、TRIM蛋白による基質蛋白に対するユビキチン化やISG15化をはじめとする蛋白修飾が、NF-κBシグナルをはじめとした様々なシグナル伝達を制御し、その破綻が癌やウイルス感染症の病態生理において重要な役割を果たしている可能性を見出している。本研究課題においてはこれら分子機構を明らかにし、疾患の診断ならびに治療へと臨床応用へ展開することを目的とし、研究を行っている(図2)。
【参考文献】
- Azuma K, Urano T, Ouchi Y, Inoue S: Glucocorticoid-induced gene tripartite motif-containing 63 (TRIM63) promotes differentiation of osteoblastic cells. Endocr J 57:455-462, 2010.
- Urano T, Usui T, Takeda S, Ikeda K, Okada A, Ishida Y, Iwayanagi T, Otomo J, Ouchi Y, Inoue S: TRIM44 interacts with and stabilizes terf, a TRIM ubiquitin E3 ligase. Biochem Biophys Res Commun 383:263-268, 2009.
- Gack MU, Albrecht RA, Urano T, Inn KS, Huang IC, Carnero E, Farzan M, Inoue S, Jung JU, García-Sastre A: Influenza A virus NS1 targets the ubiquitin ligase TRIM25 to evade recognition by RIG-I. Cell Host Microbe 5:439-449, 2009.
- Gack MU, Shin YC, Joo CH, Urano T, Liang C, Sun L, Takeuchi O, Akira S, Chen Z, Inoue S, Jung JU: TRIM25 RING-finger E3 ubiquitin ligase is essential for RIG-I-mediated antiviral activity. Nature 446:916-921, 2007.
- Nakasato N, Ikeda K, Urano T, Horie-Inoue K, Takeda S, Inoue S: A ubiquitin E3 ligase Efp is up-regulated by interferons and conjugated with ISG15. Biochem Biophys Res Commun 351:540-546, 2006.
- Suzuki T, Urano T, Tsukui T, Horie-Inoue K, Moriya T, Ishida T, Muramatsu M, Ouchi Y, Sasano H, Inoue S: Estrogen-responsive finger protein as a new potential biomarker for breast cancer. Clin Cancer Res 11:6148-6154, 2005.
- Urano T, Takahashi S, Suzuki T, Fujimura T, Fujita M, Kumagai J, Horie-Inoue K, Sasano H, Kitamura T, Ouchi Y, Inoue S: 14-3-3s is down-regulated in human prostate cancer. Biochem Biophys Res Commun 319:795-800, 2004.
- Urano T, Saito T, Tsukui T, Fujita M, Hosoi T, Muramatsu M, Ouchi Y, Inoue S: Efp targets 14-3-3σ for proteolysis and promotes breast tumour growth. Nature 417:871-875, 2002.
- Inoue S, Urano T, Ogawa S, Saito T, Orimo A, Hosoi T, Ouchi Y, Muramatsu M: Molecular cloning of rat efp: expression and regulation in primary osteoblasts. Biochem Biophys Res Commun 261:412-418, 1999.
- Urano T, Yashiroda H, Muraoka M, Tanaka K, Hosoi T, Inoue S, Ouchi Y, Tanaka K, Toyoshima H: p57Kip2 is degraded through the proteosome in osteoblasts stimulated to proliferation by transforming growth factor β1. J Biol Chem 274:12197-12200, 1999.











