
ミトコンドリアを介したストレス応答におけるタンパク質切断とリン酸化の役割
 |
研究代表者 武田 弘資 長崎大学 大学院医歯薬学総合研究科 生命薬科学専攻 細胞制御学分野 教授 http://www.ph.nagasaki-u.ac.jp/research/rsh_cr.html |
【研究概要】
ミトコンドリアは、エネルギー産生の中枢機関として細胞の生存を支えると同時に、さまざまな細胞の機能制御から細胞死の誘導に至るまで、きわめて多彩な働きをもちます。しかし、ストレスにさらされた細胞のミトコンドリアでは、活性酸素種の過剰産生、ミトコンドリアDNAの損傷、マトリックスへの不良タンパク質の蓄積など、さまざまな障害が起こります。このような障害は、アポトーシスやネクローシスの誘導などによって細胞の運命に大きな影響をもたらし、がん、代謝疾患、神経変性疾患などさまざまな疾患の原因となると考えられています。よって、ミトコンドリアの障害や機能低下の状況を、ミトコンドリアの品質管理マシナリーや他のオルガネラに向けてシグナルとして発信する機構が存在し、その機構が細胞のストレス応答だけではなく、細胞の機能調節においても重要な役割を担っていると予想されます。
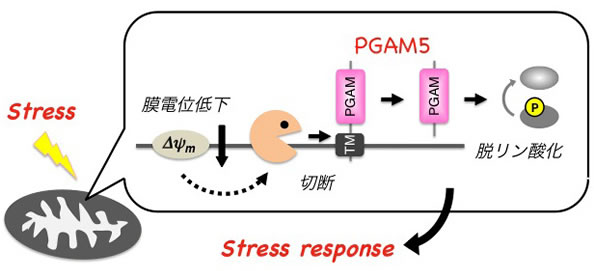
私たちが最近、ストレス応答キナーゼASK1の結合分子として見いだしたPGAM5は、そのようなミトコンドリアの機能低下をストレス応答シグナルに変換する機構の一翼を担う分子であることが分かってきました。この分子は、これまでに知られていたいずれの分子とも相同性を持たない、まったく新しいタイプのセリン・スレオニン特異的プロテインホスファターゼとして機能し、その活性依存的にASK1ならびにその下流の MAPキナーゼ経路を活性化することが、私たちの解析により明らかとなりました。PGAM5はそのN末端側に存在する膜貫通ドメインを介して主にミトコンドリアに局在していますが、興味深いことに私たちは、さまざまな細胞傷害性ストレスによって引き起こされるミトコンドリアの機能低下(膜電位低下)にともなって、PGAM5が分子内で切断されることを明らかにしました(投稿準備中)。よってPGAM5は膜電位低下に応答して切断を受け、おそらくはその局在やホスファターゼとしての活性を変化させることで、ミトコンドリアの状況を他の分子にシグナルとして伝達する役割を担っていると予想されます。本研究では、ミトコンドリアの膜電位低下を受容する機構としてのPGAM5の切断、ならびにPGAM5の脱リン酸化活性を用いたシグナル伝達に着目し、ミトコンドリアを介したストレス応答においてこれらのタンパク質修飾がどのような役割を担っているかの解明を目指します。
【参考文献】
- Takeda, K., Noguchi, T., Naguro, I. and Ichijo, H. Apoptosis signal-regulating kinase 1 in stress and immune response. Annu. Rev. Pharmacol. Toxicol. (review article) 48, 199-225 (2008)
- Takeda, K., Komuro, Y., Hayakawa, T., Oguchi, H., Ishida, Y., Murakami, S., Noguchi, T., Kinoshita, H., Sekine, Y., Iemura, S., Natsume, T. and Ichijo, H. Mitochondrial phosphoglycerate mutase 5 uses alternate catalytic activity as a protein serine/threonine phosphatase to activate ASK1. Proc. Natl. Acad. Sci. USA. 106, 12301-12305 (2009)
- Imai, Y., Kanao, T., Sawada, T., Kobayashi, Y., Moriwaki, Y., Ishida, Y., Takeda, K., Ichijo, H., Lu, B. and Takahashi, R. The loss of PGAM5 suppresses the mitochondrial degeneration caused by inactivation of PINK1 in Drosophila. PLoS Genet. 6, e1001229 (2010)
- Takeda, K. PGAM5: a novel type of protein serine/threonine phosphatase that exists in the mitochondria. J. Oral Biosci. (review article) 53, 122-127 (2011)
- 武田弘資.注目され始めた“アティピカル・プロテインホスファターゼ”.細胞工学 30 (6), 626-630 (2011)











