
翻訳後修飾によるLrp4シグナル制御機構とその破綻
 |
研究代表者 山梨裕司 東京大学医科学研究所 腫瘍抑制分野 http://www.ims.u-tokyo.ac.jp/genetics/html/home.html |
【研究概要】
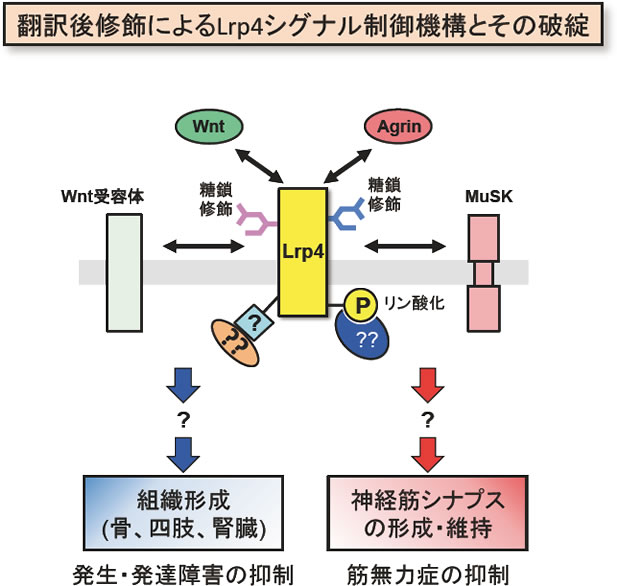
多細胞生物がその形態や機能を維持・発揮するためには細胞間の情報伝達が不可欠の要素となります。そのような情報伝達を担う細胞表面上の受容体分子の局在や機能の制御には、細胞内領域のリン酸化やユビキチン化等の翻訳後修飾と共に、細胞外領域の糖鎖修飾が必須の役割を果たしています。Lrp4(LDL receptor-related protein 4)は、その名の通りLDL(low-density lipoprotein)受容体に類縁の酵素活性を持たない受容体分子であり、当該ファミリーに特徴的なLDL-Aリピートとβプロペラ構造を細胞外領域に保持しています。これまでの多様な遺伝子改変マウスの研究から、Lrp4は骨、四肢、腎臓、そして、神経筋シナプス(NMJ)の形成に必須の役割を担っていることが明らかにされています。さらに、近年の研究により、骨の過形成による神経障害を伴う硬結性骨化症(sclerosteosis)や四肢・腎の形成不全を伴うCenani-Lenz合指症の原因遺伝子として、ヒトLRP4遺伝子が報告されています。これらの疾患については、骨・腎形成に必須の骨芽細胞や尿管芽におけるLrp4のWntシグナル抑制機能の重要性が示唆されていますが、その分子病態は未解明です。また、これらのLrp4疾患では明らかなNMJ機能の異常が認められないことから、Lrp4のNMJ形成における機能は四肢、腎臓、骨形成における機能とは必ずしも同一ではないと考えられています。事実、NMJ形成においては運動神経由来のAgrinや骨格筋上の受容体型チロシンキナーゼMuSK等との相互作用の重要性が明らかにされています。このように、Lrp4は骨、四肢、腎臓、NMJの形成に必須のシグナル分子であり、その機能不全は様々な疾患の原因となることが明らかになっていますが、Lrp4シグナルの実体、特に、Lrp4シグナルがどのように制御されているかについては明らかになっていません。そこで、本研究者らはLrp4の翻訳後修飾と会合分子に関する解析を開始し、Lrp4の細胞表面への局在制御に重要な糖鎖修飾と会合分子を同定すると共に、Lrp4の細胞内リン酸化部位の同定を進めています。
以上の諸点を踏まえ、本研究では翻訳後修飾によるLrp4シグナル制御機構の解明を目指し、様々な翻訳後修飾と会合分子に関する解析を実施します。その上で、それらの解析によって明らかになったLrp4分子の翻訳後修飾に制御される個々のシグナル経路の解明を進めます。さらに、これらの基盤的な解析から得られた知見を踏まえて、本新学術領域領域の構造生物学的な解析と数理科学的な解析を担当するグループとの緊密な連携により、Lrp4分子を介した翻訳後修飾シグナルの多元的、統合的な理解を進めると同時に、上述のLrp4関連疾患における翻訳後修飾シグナル異常の解析を実行し、その分子病態の解明を進めます。
【参考文献】
- Mashima R, Arimura S, Kajikawa S, Oda H, Nakae S, & Yamanashi Y. Dok adaptors play anti-inflammatory roles in pulmonary homeostasis. Genes Cells, 18, 56-65 (2013).
- Higuchi O, Hamuro J, Motomura M, & Yamanashi Y. Autoantibodies to LDL receptor-related protein 4 in myasthenia gravis. Annals of Neurology, 69, 418-422 (2011).
- Inoue A, Setoguchi K, Matsubara Y, Okada K, Sato N, Iwakura Y, Higuchi O, & Yamanashi Y. Dok-7 activates the muscle receptor kinase MuSK and shapes synapse formation. Sci. Signal. 2, ra7 (2009)
- Hosooka T, Noguchi T, Kotani K, Nakamura T, Sakaue H, Inoue H, Ogawa W, Tobimatsu K, Takazawa K, Sakai M, Matsuki Y, Hiramatsu R, Yasuda T, Lazar M, Yamanashi Y, & Kasuga M. Dok-1 mediates high-fat diet-induced adipocyte hypertrophy and obesity through modulation of PPARγ phosphorylation. Nature Med. 14, 188-193 (2008)
- Beeson D, Higuchi O, Palace J, Cossins J, Spearman H, Maxwell S, Newsom-Davis J, Burke G, Fawcett P, Motomura M, Muller J, Lochmuller H, Slater C, Vincent A, & Yamanashi Y. Dok-7 mutations underlie a neuromuscular junction synaptopathy. Science 313, 1975-1978 (2006)
- Okada K, Inoue A, Okada M, Murata Y, Kakuta S, Jigami T, Kubo S, Shiraishi H, Eguchi K, Motomura M, Akiyama T, Iwakura Y, Higuchi O, & Yamanashi Y. The muscle protein Dok-7 is essential for neuromuscular synaptogenesis. Science 312, 1802-1805 (2006)
- Shinohara H, Inoue A, Toyama-Sorimachi N, Nagai Y, Yasuda T, Suzuki H, Horai R, Iwakura Y, Yamamoto T, Karasuyama H, Miyake K, & Yamanashi Y. Dok-1 and Dok-2 are negative regulators of lipopolysaccharide-induced signaling. J. Exp. Med. 201, 333-339 (2005)
- Yasuda T, Shirakata M, Iwama A, Ishii A, Ebihara Y, Osawa M, Honda K, Shinohara H, Sudo K, Tsuji K, Nakauchi H, Iwakura Y, Hirai H, Oda H, Yamamoto T, & Yamanashi Y. Role of Dok-1 and Dok-2 in myeloid homeostasis and suppression of leukemia. J. Exp. Med. 200, 1681-1687 (2004)
- Yamanashi Y, Tamura T, Kanamori T, Yamane H, Nariuchi H, Yamamoto T, & Baltimore D. Role of the rasGAP-associated docking protein p62dok in negative regulation of B cell receptor-mediated signaling. Genes Dev. 14, 11-16 (2000)
- Yamanashi Y & Baltimore D. Identification of Abl- and rasGAP-associated 62 kDa protein as a docking protein, Dok. Cell 88, 205-211 (1997)











