
GPI修飾の新規メカニズムとその破綻によるシグナル伝達異常の解明
 |
研究代表者 後藤聡 立教大学、理学部、生命理学科 http://goto-lab.net/ |
【研究概要】
糖鎖修飾はほとんどの分泌タンパク質や膜タンパク質に施される翻訳後修飾である。その一種であるGPI(glycosylphosphatidylinositol)修飾は、糖脂質であるGPIがタンパク質に共有結合することで、そのタンパク質を細胞膜に係留させる。このGPIで係留されるタンパク質は数多く存在する。さらに、そのようなGPI結合タンパク質は、さまざまな生物学的プロセスで重要な役割を果たしており、その異常は発作性夜間血色素尿症などの疾病を引き起こす。
そのように重要なGPI修飾は小胞体で行われ、その生化学的プロセスについては多くの知見が得られている。しかし、実際の生体を用いた解析はこれからの課題である。そこで、私達はショウジョウバエをモデル系に用い、生体におけるGPI修飾の制御について解析を行っている。
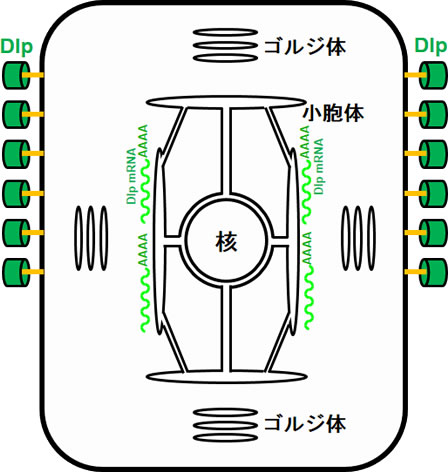
ショウジョウバエのGPI結合タンパク質の一つであるDally-like protein (Dlp)は、発生・分化や神経機能に重要な役割を果たすことがわかっている。そこで、DlpのGPI修飾に着目し解析をおこなっている。具体的には、どの細胞内コンパートメントでDlp mRNAは翻訳され、GPI修飾が施されているのか?そのコンパートメントでGPI修飾されることにはどのようなメリットがあるのか?その破綻でどのような異常が生じるのか?について解析を進めている。
また、酵母において、GPI結合タンパク質は他の膜タンパク質とは異なる輸送小胞によって小胞体からゴルジ体へ輸送されることが報告されている。このことは、GPI結合タンパク質は他のタンパク質とは異なるゴルジ体に輸送されることを示唆している。ショウジョウバエの分散型ゴルジ体は、それぞれ異なる機能を持っているので、DlpなどのGPI結合タンパク質の特異的機能の発現に、この選択輸送は重要な役割を果たす可能性がある。その点についても解析を進めている。
参考文献
- Cisterna-specific localization of glycosylation-related proteins to the Golgi apparatus.
Yamamoto-Hino,M., Abe,M., Shibano,T., Setoguchi,Y., Awano,W., Ueda.R., Okano,H. and Goto,S.
Cell Struct. Funct., 37, 55-63 (2012)
- Balanced ubiquitination determines cellular responsiveness to extracellular stimuli.
Mukai,A., Yamamoto-Hino,M., Komada.M., Okano,H. and Goto,S.
Cellular and Molecular Life Sciences, 69, 4007-4016 (2012)
- Structure, Function and Formation of Glycans in Drosophila.
Yamamoto-Hino,M., Okano,H., Kanie,O. and Goto,S.
- In “Glycans: Biochemistry, Characterization and Applications.” pp.165-188
Mora Montes, H. M. ed.
- Nova Science publishers, Inc., NY (2012)
Identification of genes required for neural-specific glycosylation using functional genomics.
- Yamamoto-Hino,M., Kanie,Y., Awano,W., Aoki-Kinoshita,K.F., Yano,H., Nishihara,S., Okano,H., Ueda,R., Kanie,O. and Goto,S.
PLoS Genetics, 6, e1001254 (2010)
- Balanced ubiquitylation and deubiquitylation of Frizzled regulate cellular responsiveness to Wingless/Wnt.
Mukai,A., Yamamoto-Hino,M., Awano,W., Watanabe,W., Komada,M. and Goto,S.
The EMBO J., 29, 2114-2125 (2010)
- Autophagy-dependent rhodopsin degradation prevents retinal degeneration in Drosophila.
Midorikawa,R., Yamamoto-Hino,M., Awano,W., Hinohara,Y., Ueda,R. and Goto,S.
J. Neurosci., 30, 10703-10719 (2010)
- Distinct functional units of the Golgi complex in Drosophila cells.
Yano,H., Yamamoto-Hino,M., Abe,M., Kuwahara,R., Haraguchi,S., Kusaka,I., Awano,W., Kinoshita-Toyoda,A., Toyoda,H. and Goto,S.
Proc. Natl. Acad. Sci. USA 102, 13467-13472 (2005)
- UDP-sugar transporter implicated in glycosylation and processing of Notch.
Goto,S., Taniguchi,M., Muraoka,M., Toyoda,H., Sado,Y., Kawakita,M. and Hayashi,S.
Nature Cell Biol. 3, 816-822 (2001)











