
慢性腎臓病におけるp53の翻訳後修飾の関与
 |
研究代表者 甲斐広文 熊本大学大学院生命科学研究部(薬学系)・遺伝子機能応用学分野・教授 http://molmed730.org |
【研究概要】
慢性腎臓病(Chronic Kidney Failure; CKD)に罹患する患者数の増加は多くの先進国において極めて重大な問題となっている。CKDの病態形成には多様な分子, 細胞群の複雑なクロストークが関与していることから, 引き金となり得る機構の解明が治療法開発の基盤となる。
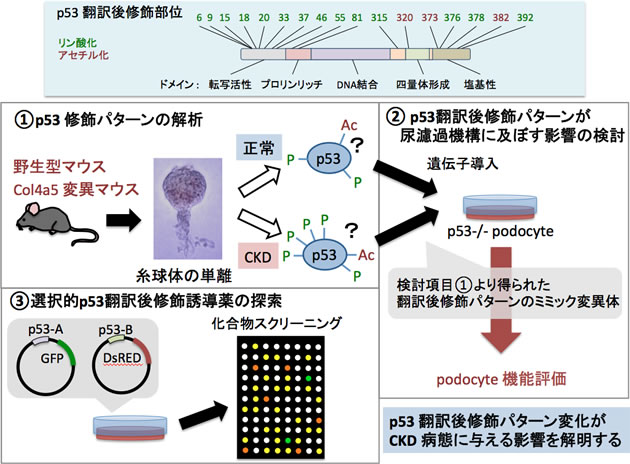
現在までの検討の結果, CKDモデルであるCol4a5遺伝子変異マウスを用いた解析の結果, 癌抑制遺伝子として知られるp53の欠損によって腎病態が顕著に悪化することが示されている。また, p53の欠損は腎糸球体上皮細胞 (podocyte) において遊走促進や尿濾過に必須な遺伝子群の発現低下に寄与することも示され, 腎病態の進行の抑制にもp53が関与していることが示唆されている。
p53はユビキタスに発現する転写因子であり, その機能は14カ所のリン酸化部位, 3カ所のアセチル化部位に加え, ユビキチン化, SUMO化, モノメチル化といった数多くの翻訳後修飾の組み合わせによって高度に制御されており, 標的遺伝子の多様性から, 近年では免疫や代謝といった極めて多彩な生体応答への関与が示されている。
p53の翻訳後修飾は腎臓発生早期においてrenal function genes (RFGs) の発現制御に重要であることが示されているものの, 腎発生後及び腎病態形成時の腎臓におけるp53の機能は未解明な点が多い。
そこで, 本研究課題ではCKD病態形成におけるp53翻訳後修飾の寄与に着目し, 検討を行う。まず第一にCKD病態進行過程におけるp53翻訳後修飾パターンに変化が見られるかを検討するため, 病態初期, 中期, 末期の週齢に該当する野生型マウス及びCol4a5変異マウスより糸球体を単離し, 各翻訳後修飾p53に対する抗体でWestern blotを行い, 各翻訳後修飾パターンを定量的に比較する。第二に, 正常時及び, CKD病態時に糸球体において観察されたp53翻訳後修飾パターンのミミック変異体を作製し, p53欠損podocyteに導入した後, 遊走能, 尿濾過機能の測定及び, 尿濾過機能遺伝子群の発現解析を行い, p53翻訳後修飾パターンの違いが腎機能に及ぼす影響を検討する。p53標的遺伝子promoter上のp53結合配列は標的遺伝子によって異なっており, この違いがp53翻訳後修飾パターンによる転写標的の選択性を生んでいる(7)。そこで第三の検討項目では, この選択機構を利用し, アポトーシスを誘導する遺伝子(BAX, p53AIP等)のp53結合配列(p53-A)と腎機能維持に重要とされるp53標的遺伝子(p21, BMP-7等)のp53結合配列(p53-B)をそれぞれpromoterに導入したGFP, DsRED vectorを作製した後(p53-A-GFP, p53-B-DsRED vec), これらvectorを安定的に発現する細胞株を樹立し薬剤のスクリーニングに用いることで選択的なp53翻訳後修飾誘導薬の同定を行う。
以上の検討によりp53のCKD病態形成への関与を調べ, p53翻訳後修飾を標的とした新規なCKD治療薬の開発を目指す。
参考文献
- Fukuda R, Suico MA, Koyama K, Omachi K, Kai Y, Matsuyama S, Mitsutake K, Taura M, Morino-Koga S, Shuto T, Kai H. Mild electrical stimulation at 0.1-ms pulse width induces p53 protein phosphorylation and G2 arrest in human epithelial cells. J Biol Chem. 288: 16117-26 (2013)
- Koga T, Kai Y, Fukuda R, Morino-Koga S, Suico MA, Koyama K, Sato T, Shuto T, Kai H. Mild electrical stimulation and heat shock ameliorates progressive proteinuria and renal inflammation in mouse model of alport syndrome. PLoS One. 7(8): e43852 (2012)
- Sato T, Sako Y, Sho M, Momohara M, Suico MA, Shuto T, Nishitoh H, Okiyoneda T, Kokame K, Kaneko M, Taura M, Miyata M, Chosa K, Koga T, Koga SM, Wada I, Kai H. STT3B-dependent posttranslational N-glycosylation as a novel surveillance system for secretory protein. Mol Cell 47: 99-110 (2012)
- Taura M, Suico MA, Koyama K, Komatsu K, Miyakita R, Matsumoto C, Kudo E, Kariya R, Goto H, Kitajima S, Takahashi C, Shuto T, Nakao M, Okada S, and Kai H. Rb/E2F1 regulates the innate immune receptor Toll-like receptor 3 in epithelial cells. Mol Cell Biol. 32:1581-90 (2012)
- Taura M, Suico MA, Fukuda R, Koga T, Shuto T, Sato T, Morino-Koga S, Okada S, Kai H.
MEF/ELF4 transactivation by E2F1 is inhibited by p53.
Nucleic Acids Res. 39: 76-88 (2011) - Taura M, Fukuda R, Suico MA, Eguma A, Koga T, Shuto T, Sato T, Morino-Koga S, Kai H. TLR3 induction by anticancer drugs potentiates poly I:C-induced tumor cell apoptosis. Cancer Sci. 101: 1610-1 (2010).
- Taura M, Eguma A, Suico MA, Shuto T, Koga T, Komatsu K, Komune T, Sato T, Saya H, Li JD Kai H, p53 regulates TLR3 expression and function in human
epithelial cell lines. Mol. Cell. Biol. 28: 6557-6567 (2008)











