
パルミトイル化によるタンパク質機能調節と病態の分子機構
 |
研究代表者 木原章雄 北海道大学 大学院薬学研究院 http://www.pharm.hokudai.ac.jp/seika/ |
【研究概要】
タンパク質の翻訳後修飾には,パルミトイル化(S-アシル化),ミリストイル化,プレニル化,GPIアンカー等があるがこの中でパルミトイル化が最も多く見られる脂質修飾であり,唯一可逆的である。パルミトイル化はタンパク質のシステイン残基に炭素数16のパルミチン酸が付加される修飾である。パルミトイル化により修飾されたタンパク質の疎水性は上昇し,細胞内局在,構造,活性,安定性などが変化する。パルミトイル化されるタンパク質にはシグナル伝達に関わるものが多く,例えばRas,Gタンパク質共役型受容体(GPCR),Gタンパク質αサブユニット,SrcキナーゼファミリーLynなどが含まれる。我々はこれまでにスフィンゴシン1-リン酸受容体(S1P1-5)及びリゾホスファチジン酸受容体(LPA2)などのGPCR(5, 6),カルネキシン(3),スフィンゴシンキナーゼ(マウスSPHK1b,酵母Lcb4)(8, 10)がパルミトイル化されることを明らかにしてきた。また,セリンラセマーゼは通常とは異なったO-アシル化を受けることも見いだしている(7)。
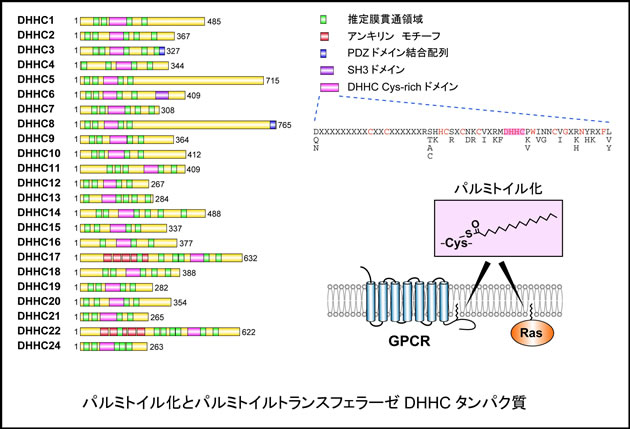
パルミトイル化を受けるシステイン残基には厳密な配列モチーフは存在しないが,下記のような6つのパターンに分類することができる。1) 可溶性タンパク質のN末端付近のシステイン残基,2) 可溶性タンパク質のC末端付近のシステイン残基,3) 可溶性タンパク質の内側に位置するシステイン残基,4) 別種脂質修飾(ミリストイル化あるいはプレニル化)を受けたアミノ酸近傍のシステイン残基,5) 1回膜貫通タンパク質の膜貫通領域近傍のシステイン残基,6) 複数膜貫通タンパク質の膜貫通領域近傍のシステイン残基。パルミトイル化はパルミトイルトランスフェラーゼ(プロテインアシルトランスフェラーゼ;PAT)により触媒される。PATはDHHCシステインリッチモチーフを共通に持つタンパク質ファミリー(DHHCタンパク質ファミリー)であり,ヒトに23種(DHHC1-24),酵母に7種(Akr1,Akr2,Erf2,Swf1,Pfa3,Pfa4,Pfa5)存在する。我々はこれまでにヒトDHHC遺伝子全てをクローニングし,それぞれの組織発現,細胞内局在を明らかにしてきた(9)。また,最近酵母にヒトDHHCタンパク質を発現させて活性を測定する系を構築し,DHHCタンパク質それぞれの基質特異性を明らかにすることに成功した(1)。この解析により23種のヒトDHHCタンパク質のうち少なくとも17種がPAT活性を持つことを明らかにし,このうち4種は我々が初めてPATであることを示した。DHHCタンパク質は厳密な基質特異性を示さないが,上記の6つのカテゴリーの基質単独あるいは複数に対して活性を示すことが明らかとなった。
GPCRは創薬ターゲットの約半数を占める重要なタンパク質である。GPCRの約8割には最後の膜貫通領域付近にシステイン残基が存在し,パルミトイル化を受けると予測されている。しかし,これまでGPCRのPATは同定されていないため,パルミトイル化による調節機構には不明な点が多い。そこで本課題では,最近我々が構築した各DHHCタンパク質の活性を検出する系を用いてGPCRのPATの同定を目指す。また,PATにはこれまで特異的な阻害剤が存在しない。我々は新規のPAT特異的阻害剤の単離を行い,パルミトイル化研究のツールあるいはパルミトイル化関連疾患への応用を目指す。さらには,これまでの知見を活かし,新規パルミトイル化タンパク質の同定を目指す。
【参考文献】
- Ohno, Y., Kashio, A., Ogata, R., Ishitomi, A., Yamazaki, Y., and Kihara, A. (2012) Analysis of substrate specificity of human DHHC protein acyltransferases using a yeast expression system. Mol. Biol. Cell, 23, 4543-4551
- Nakahara, K., Ohkuni, A., Kitamura, T., Abe, K., Naganuma, T., Ohno, Y., Zoeller, R.A., and Kihara, A. (2012) The Sjogren-Larsson syndrome gene encodes a hexadecenal dehydrogenase of the sphingosine 1-phosphate degradation pathway. Mol. Cell, 46, 461-471
- Lakkaraju, A.K., Abrami, L., Lemmin, T., Blaskovic, S., Kunz, B., Kihara, A., Dal Peraro, M., and van der Goot, F.G. (2012) Palmitoylated calnexin is a key component of the ribosome-translocon complex. EMBO J., 31, 1823-1835
- Ohno, Y., Suto, S., Yamanaka, M., Mizutani, Y., Mitsutake, S., Igarashi, Y., Sassa, T., and Kihara, A. (2010) ELOVL1 production of C24 acyl-CoAs is linked to C24 sphingolipid synthesis. Proc. Natl. Acad. Sci. USA, 107, 18439-18444
- Ohno, Y., Ito, A., Ogata, R., Hiraga, Y., Igarashi, Y., and Kihara, A. (2009) Palmitoylation of the sphingosine 1-phosphate receptor S1P is involved in its signaling functions and internalization. Genes Cells, 14, 911-923
- E, S., Lai, Y.J., Tsukahara, R., Chen, C.S., Fujiwara, Y., Yue, J., Yu, J.H., Guo, H., Kihara, A., Tigyi, G., and Lin, F.T. (2009) Lysophosphatidic acid 2 receptor-mediated supramolecular complex formation regulates its antiapoptotic effect. J. Biol. Chem., 284, 14558-14571
- Balan, L., Foltyn, V.N., Zehl, M., Dumin, E., Dikopoltsev, E., Knoh, D., Ohno, Y., Kihara, A., Jensen, O.N., Radzishevsky, I.S., and Wolosker, H. (2009) Feedback inactivation of D-serine synthesis by NMDA receptor-elicited translocation of serine racemase to the membrane. Proc. Natl. Acad. Sci. USA, 106, 7589-7594
- Kihara, A., Anada, Y., and Igarashi, Y. (2006) Mouse sphingosine kinase isoforms SPHK1a and SPHK1b differ in enzymatic traits including stability, localization, modification, and oligomerization. J. Biol. Chem., 281, 4532-4539
- Ohno, Y., Kihara, A., Sano, T., and Igarashi, Y. (2006) Intracellular localization and tissue-specific distribution of human and yeast DHHC cysteine-rich domain-containing proteins. Biochim. Biophys. Acta, 1761, 474-483
- Kihara, A., Kurotsu, F., Sano, T., Iwaki, S., and Igarashi, Y. (2005) Long-chain base kinase Lcb4 is anchored to the membrane through Its palmitoylation by Akr1. Mol. Cell. Biol., 25, 9189-9197











