
リソソームの制御におけるmTORC1の機能解析
 |
研究代表者 岡田雅人 大阪大学 微生物病研究所 発癌制御研究分野 http://www.biken.osaka-u.ac.jp/biken/oncogene/index.htm |
【研究概要】
細胞の成長・増殖には、栄養素やエネルギー源の適切な供給によるタンパク質、核酸、脂質など細胞構成物質の生合成が必要となる。一方、栄養素やエネルギー源が枯渇した場合には、生合成プログラムが停止し、老化したタンパク質やオルガネラをリサイクル(オートファジー)することによって生存維持が図られる。このような成長と飢餓のインターフェースにおいてTOR(Target of Rapamycin)キナーゼを介するシグナル伝達経路が重要な役割を担う。TORは真核生物で高度に保存されたキナーゼであり、哺乳動物のmTORは成長とホメオスタシス維持の中心的なコントローラーとして機能し、がん、代謝病、老化などによる病態との強い関連性が示されている。mTORには、ラパマイシン感受性のmTORC1 (complex 1)と非感受性のmTORC2 (complex 2)の2種類が存在する。主にmTORC1が成長と飢餓のインターフェースで機能し、富栄養状態ではタンパク質の翻訳などを促進することによって細胞の成長を担保する。一方、飢餓状態では、mTORC1が不活化されることによってオートファジーが誘導される。また、インスリン刺激などによって活性化されるAkt経路を介してもmTORC1は活性化され、細胞の成長に促進的に作用する。一方、mTORC2は、Aktの活性化を介して細胞の生存維持を促し、Rho GTPaseを活性化して細胞骨格系の制御を担う。
近年、mTORC1の活性化がリソソームの膜表面上で起こることが見いだされ、その複雑な分子機序が明らかにされた(図1)。mTORC1は、リソソーム膜アダプター複合体(Ragulator; p18-p14-MP1)およびGag GTPasesを介してリソソームに局在化し、リソソーム表面のRheb GTPaseによって活性化される(Cell, 2010)。我々は、Ragulator複合体の膜アンカーであるp18を初めて同定し(EMBO J, 2009)、mTORC1の活性化機構の一端を明らかにしてきた。p18は、パルミチン酸及びミリスチン酸の脂質修飾を受けて、リソソームの脂質ラフトに局在化する。これまでのp18欠損マウスなどを用いた解析より、p18-mTORC1が細胞の増殖や成長に必須であること、及び、p18-mTORC1がリソソームの成熟や機能発現において必須の役割を担うことを明らかにしてきた。p18欠損マウス胚組織では未消化物が溜まった小さなリソソームが蓄積し(EMBO, 2009)、培養細胞系においても、未成熟なリソソームが蓄積し取り込んだ物質の消化効率が著しく低下することが見いだされている(BBRC, 2012)。さらに、p18欠損表皮組織では、オートファゴソームの蓄積が認められ、リソソームを介する細胞内成分の分解が遅滞することによって、角化細胞への終末分化が阻害されることも観察されている(JCS, 2013)。
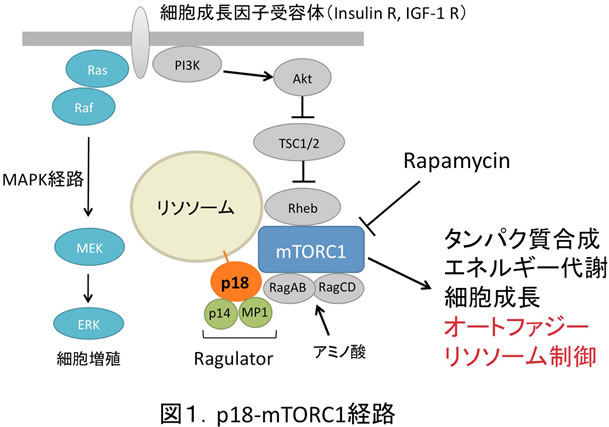
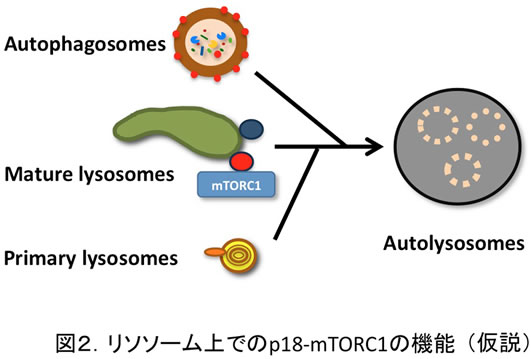
こうしたp18-mTORC1によるリソソーム制御の作用点を特定するために、リソソームの動態を詳細に解析した結果、リソソームと標的オルガネラ(オートファゴソームなど)との融合がp18の欠損によって阻害されることが見いだされた(図2)。また、同様の現象が正常細胞をラパマイシン処理しても観察されることから、p18-mTORC1のキナーゼ活性がリソソームを介する細胞内成分の分解・異化反応を統御する可能性が示唆されている。しかしながら、その標的分子は全く不明である。そこで本研究では、主にプロテオミクス解析の手法を用いて、リソソームの制御に関わる新たなp18-mTORC1キナーゼの標的分子の同定を第一の目標とする。次いで、その分子の機能解析を通してp18-mTORC1のリソソーム上での役割を明らかにし、細胞の成長や生存維持の制御におけるmTORC1の機能の全容解明に迫る。
参考文献
- Nada S, Hondo A, Kasai A, Koike M, Saito K, Uchiyama Y, Okada M. The novel lipid raft adaptor p18 controls endosome dynamics by anchoring the MEK-ERK pathway to late endosomes. EMBO J. 2009 Mar 4;28(5): 477-89. doi:10.1038/emboj.2008.308.
- Sancak Y, Bar-Peled L, Zoncu R, Markhard AL, Nada S, Sabatini DM. Ragulator-Rag complex targets mTORC1 to the lysosomal surface and is necessaryfor its activation by amino acids. Cell. 2010 Apr 16;141(2): 290-303. doi: 10.1016/j.cell.2010.02.024.
- Yoshida S, Hong S, Suzuki T, Nada S, Mannan AM, Wang J, Okada M, Guan KL, Inoki K. Redox regulates mammalian target of rapamycin complex 1 (mTORC1) activity by modulating the TSC1/TSC2-Rheb GTPase pathway. J Biol Chem. 2011 Sep 16;286(37): 32651-60. doi: 10.1074/jbc.M111.238014.
- Takahashi Y, Nada S, Mori S, Soma-Nagae T, Oneyama C, Okada M. The late endosome/lysosome-anchored p18-mTORC1 pathway controls terminal maturation of lysosomes. Biochem Biophys Res Commun. 2012 Jan 27;417(4): 1151-7. doi:10.1016/j.bbrc.2011.12.082.
- Soma-Nagae T, Nada S, Kitagawa M, Takahashi Y, Mori S, Oneyama C, Okada M. The lysosomal signaling anchor p18/LAMTOR1 controls epidermal development by regulating lysosome-mediated catabolic processes. J Cell Sci. 2013, in press
- Nada S, Mori S, Takahashi Y, Okada M. p18/LAMTOR1: a late endosome/lysosome-specific anchor protein for the mTORC1/MAPK signaling pathway. Methods in Enzymology 2013, in press











