
リソソーム障害により誘導される自然免疫の制御における翻訳後修飾系の役割
 |
研究代表者 齊藤達哉 大阪大学・微生物病研究所・准教授 http://hostdefense.ifrec.osaka-u.ac.jp/ja/ 2015年4月1日より 徳島大学疾患酵素学研究センター・教授 |
【研究概要】
自然免疫機構は、病原体の構成成分をパターン認識受容体により感知し、感染防御応答を誘導する。また、自然免疫機構は、過栄養摂取により蓄積する自己代謝物や大気中の汚染物質に対してもパターン認識受容体を介して反応するため、生活習慣病や肺炎などの炎症性疾患の発症要因ともなる。パターン認識受容体による異物の感知から炎症性サイトカインやI型インターフェロンの産生に至るまでの情報伝達には、様々な翻訳後修飾系が関わっている。私達は、タンパク質分解、ユビキチン化、リン酸化やアセチル化などの翻訳後修飾系に着目した研究を行い、免疫応答制御の分子機序を解明してきた(参考文献1-10)。本研究では、翻訳後修飾をキーワードに、リソソームの損傷により誘導される自然免疫応答についての解析を進めていきたい。
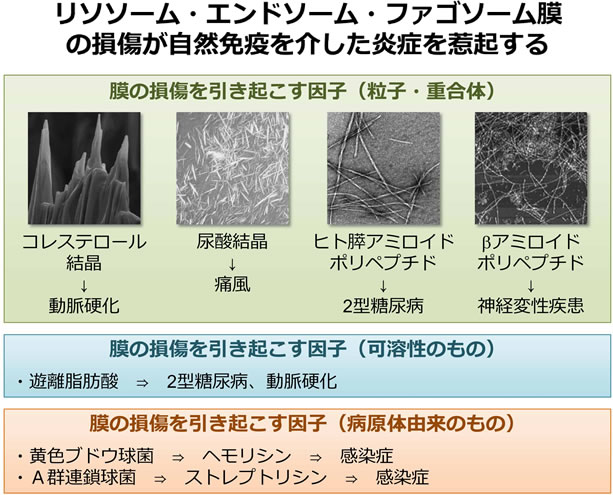
マクロファージをはじめとした貪食細胞において、Nod-like receptorファミリーに属するパターン認識受容体であるNLRP3は、情報伝達因子ASCおよびプロテアーゼCaspase-1と共にNLRP3インフラマソームと呼ばれるタンパク質複合体を形成し、サイトカインIL-1やIL-18の成熟・産生を介して炎症を惹起する。NLRP3インフラマソームは、病原体の感染によってリソソームの膜が損傷を受けた際に活性化し、感染防御応答を誘導する。また、NLRP3インフラマソームは、鋭利な末端を有する刺激性粒子である尿酸結晶やアスベストなどによってリソソームの膜が損傷を受けた際には過度に活性化し、重篤な組織障害を引き起こす。よって、NLRP3インフラマソームは、感染症や炎症性疾患の有力な治療標的と考えられている。
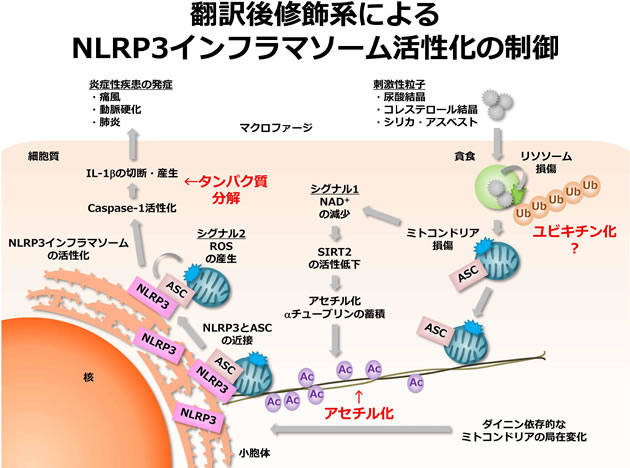
最近私達は、痛風治療薬である微小管重合阻害剤コルヒチンが尿酸結晶によるNLRP3インフラマソームの活性化を抑制する機序を明らかにした(参考文献1)。尿酸結晶などのNLRP3インフラマソーム活性化因子を貪食したマクロファージにおいては、リソソームの損傷がミトコンドリアの損傷をさらに引き起こす。その後、ミトコンドリアは微小管上を微小管形成中心方向へと移動・集積し、小胞体と近接する頻度が高まる。NLRP3インフラマソームを形成するNLRP3とASCはそれぞれ小胞体とミトコンドリアに主に局在しているため、微小管を介した両オルガネラの近接はNLRP3インフラマソームの会合を促進する。コルヒチンは、微小管を介した小胞体とミトコンドリアの近接を阻害することにより、NLRP3インフラマソームの会合を抑制する。興味深いことに、ミトコンドリアの移動・集積は、αチューブリンのアセチル化によって促進される。尿酸結晶などのNLRP3インフラマソーム活性化因子は、細胞内Nicotinamide adenine dinucleotide (NAD+)の減少とそれに続くαチューブリン脱アセチル化酵素SIRT2の失活を引き起こして、アセチル化αチューブリンの量を増加させる。しかしながら、刺激に応じてNAD+が低下する理由やアセチル化αチューブリンが微小管形成中心付近に蓄積する理由など不明な点が多く残されている。そこで本研究では、αチューブリンのアセチル化に関する解析を行い、微小管を介したNLRP3インフラマソームの活性化機序を明らかにする。
ユビキチン化は、プロテアソームによる基質分解、オートファジーによる基質分解や基質の機能制御などに関わることにより、様々な自然免疫応答を制御している。NLRP3インフラマソーム活性化因子の貪食により損傷したリソソームの膜上においては、ユビキチン化された基質が蓄積する。しかしながら、このリソソーム膜上でのユビキチン化の意義についてはほとんど分かっていない。そこで本研究では、リソソーム上に局在するユビキチンリガーゼや脱ユビキチン化酵素に関する解析を行い、リソソーム膜上で誘導されるユビキチン化がリソソーム膜の損傷により誘導される自然免疫の活性化において果たす役割を明らかにする。
参考文献
- Misawa T, Takahama M, Kozaki T, Lee H, Zou J, Saitoh T*, Akira S*. (*Co-corresponding authors).
Microtubue-driven spatial arrangement of mitochondria promotes activation of the NLRP3 inflammasome.
Nat Immunol. 2013, 14, 454–460. - Saitoh T, Komano J, Saitoh Y, Misawa T, Takahama M, Kozaki T, Uehata T, Iwasaki H, Omori H, Yamaoka S, Yamamoto N, Akira S.
Neutrophil extracellular traps mediate a host defense response to human immunodeficiency virus-1.
Cell Host Microbe. 2012, 12, 109-116. - Saitoh T, Satoh T, Yamamoto N, Uematsu S, Takeuchi O, Kawai T, Akira S.
Antiviral protein Viperin promotes Toll-like receptor 7- and Toll-like receptor 9-mediated type I interferon production in plasmacytoid dendritic cells.
Immunity. 2011, 34, 352-363. - Saitoh T, Akira S.
Regulation of innate immune responses by autophagy-related proteins.
J Cell Biol. 2010, 189, 925-935. - Saitoh T, Fujita N, Hayashi T, Takahara K, Satoh T, Lee H, Matsunaga K, Kageyama S, Omori H, Noda T, Yamamoto N, Kawai T, Ishii K, Takeuchi O, Yoshimori T, Akira S.
Atg9a controls dsDNA-driven dynamic translocation of STING and the innate immune response.
Proc Natl Acad Sci U S A. 2009, 106, 20842-20846. - Saitoh T, Fujita N, Jang MH, Uematsu S, Yang BG, Satoh T, Omori H, Noda T, Yamamoto N, Komatsu M, Tanaka K, Kawai T, Tsujimura T, Takeuchi O, Yoshimori T, Akira S.
Loss of the autophagy protein Atg16L1 enhances endotoxin-induced IL-1beta production.
Nature. 2008, 456, 264-268. - Saitoh T, Tun-Kyi A, Ryo A, Yamamoto M, Finn G, Fujita T, Akira S, Yamamoto N, Lu KP, Yamaoka S.
Negative regulation of interferon-regulatory factor 3-dependent innate antiviral response by the prolyl isomerase Pin1.
Nat Immunol. 2006, 7, 598-605. - Saitoh T, Yamamoto M, Miyagishi M, Taira K, Nakanishi M, Fujita T, Akira S, Yamamoto N, Yamaoka S.
A20 is a negative regulator of IFN regulatory factor 3 signaling.
J Immunol. 2005, 174, 1507-1512. - Saitoh T, Nakayama M, Nakano H, Yagita H, Yamamoto N, Yamaoka S.
TWEAK induces NF-kappaB2 p100 processing and long lasting NF-kappaB activation.
J Biol Chem. 2003, 278, 36005-36012. - Saitoh T, Nakano H, Yamamoto N, Yamaoka S.
Lymphotoxin-beta receptor mediates NEMO-independent NF-kappaB activation.
FEBS Lett. 2002, 532, 45-51.











