
イノシトールリン脂質代謝酵素の翻訳後修飾による活性変化と生理機能
 |
研究代表者 佐々木純子 秋田大学大学院医学系研究科 http://www.med.akita-u.ac.jp/~bisei/ |
【研究概要】
ホスファチジルイノシトール(PI)の3, 4, 5位水酸基が可逆的なリン酸化を受ける結果、イノシトールリン脂質(PIPs)と総称される一群のリン脂質が生じ、細胞膜に存在します(図)。リン酸化部位の組み合わせによって7種類に分類されるPIPsは、其々のPIPsに特有に結合する分子の局在や活性を制御することで、多彩な細胞機能の制御を司ります(1)。これまでに我々は、PIPs代謝の乱れが、炎症、癌、神経変性などの病態の発現につながることを明らかにしてきました(2-8)。中でも、イノシトール環の3, 4, 5位水酸基がすべてリン酸化されたPIP3の生理機能については、特に研究が進み、細胞内シグナル伝達で重要な役割を担うことが明らかになっています。従いまして、PIP3代謝酵素の調節機構を明らかにすることは、幅広い病態の分子機構解明へと繋がることが期待されます。
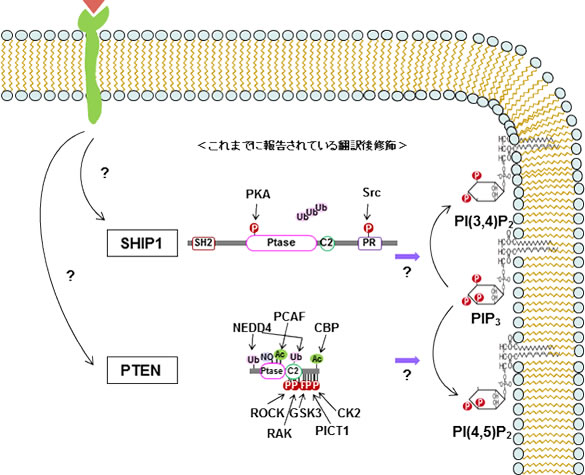
PIP3脱リン酸化酵素の代表格であり、炎症や癌に深く関与するSHIP1(phosphatidylinositol 3,4,5-trisphosphate 5-phosphatase 1)やPTEN(Phosphatase and Tensin Homolog Deleted from Chromosome 10)は、種々の翻訳後修飾を受けることが報告されています。SHIP1は、1020番目チロシン残基や440番目セリン残基がリン酸化されて活性が亢進します。また、場所は特定されておりませんが、ユビキチン化されて分解されます。PTENについては、リン酸化、ユビキチン化、アセチル化、ニトロ化と多数の翻訳後修飾が報告されており、これらの修飾は、PTENタンパク質の安定性や活性制御に関与します。予備実験において我々は、炎症性の刺激に伴い、SHIP1分子が新規の翻訳後修飾を受ける可能性と、PTENタンパク質が減少することを見出しております。また興味深いことに、同刺激において、PIPsの分子種が大きく変化することを見出しております。そこで本研究では、炎症性刺激によるSHIP1およびPTENの翻訳後修飾の分子メカニズムを解明するとともに、これらの翻訳後修飾と酵素活性との関連について解析します(図)。
参考文献
- Sasaki T, Takasuga S, Sasaki J, Kofuji S, Eguchi S, Yamazaki M & Suzuki A. Mammalian phosphoinositide kinases and phosphatases.Prog. Lipid. Res., 48, 307-343 (2009)
- Takasuga S, Horie Y, Sasaki J, Sun-Wada GH, Kawamura N, Iizuka R, Mizuno K, Eguchi S, Kofuji S, Kimura H, Yamazaki M, Horie C, Odanaga E, Sato Y, Chida S, Kontani K, Harada A, Katada T, Suzuki A, Wada Y, Ohnishi H & Sasaki T. Critical roles of type III phosphatidylinositol phosphate kinase in murine embryonic visceral endoderm and adult intestine. Proc. Natl. Acad. Sci. U S A., 110, 1726-1731 (2013)
- Sasaki J, Kofuji S, Itoh R, Momiyama T, Takayama K, Murakami H, Chida S, Tsuya Y, Takasuga S, Eguchi S, Asanuma K, Horie Y, Miura K, Davies EM, Mitchell C, Yamazaki M, Hirai H, Takenawa T, Suzuki A & Sasaki T. The PtdIns(3,4)P2 phosphatase INPP4A is a suppressor of excitotoxic neuronal death.Nature, 27, 497-501 (2010)
- Nishio M, Watanabe K, Sasaki J, Taya C, Takasuga S, Iizuka R, Balla T, Yamazaki M, Watanabe H, Itoh R, Kuroda S, Horie Y, Förster I, Mak TW, Yonekawa H, Penninger JM, Kanaho Y, Suzuki A & Sasaki T. Control of cell polarity and motility by the PtdIns(3,4,5)P3 phosphatase SHIP1. Nat. Cell Biol., 9, 36-44 (2007)
- Sasaki J, Sasaki T, Yamazaki M, Matsuoka K, Taya C, Shitara H, Takasuga S, Nishio M, Mizuno K, Wada T, Miyazaki H, Watanabe H, Iizuka R, Kubo S, Murata S, Chiba T, Maehama T, Hamada K, Kishimoto H, Frohman MA, Tanaka K, Penninger JM, Yonekawa H, Suzuki A & Kanaho Y. Regulation of anaphylactic responses by phosphatidylinositol phosphate kinase type Ia. J. Exp. Med., 21, 859-870 (2005)
- Hamada K, Sasaki T, Koni PA, Natsui M, Kishimoto H, Sasaki J, Yajima N, Horie Y, Hasegawa G, Naito M, Miyazaki J, Suda T, Itoh H, Nakao K, Mak TW, Nakano T & Suzuki A.The PTEN/PI3K pathway governs normal vascular development and tumor angiogenesis. Genes Dev., 19, 2054-2065 (2005)
- Horie Y, Suzuki A, Kataoka E, Sasaki T, Hamada K, Sasaki J, Mizuno K, Hasegawa G, Kishimoto H, Iizuka M, Naito M, Enomoto K, Watanabe S, Mak TW & Nakano T. Hepatocyte-specific Pten deficiency results in steatohepatitis and hepatocellular carcinomas.J. Clin. Invest., 113, 1774-1783 (2004)
- Sasaki T, Irie-Sasaki J, Jones RG, Oliveira-dos-Santos AJ, Stanford WL, Bolon B, Wakeham A, Itie A, Bouchard D, Kozieradzki I, Joza N, Mak TW, Ohashi PS, Suzuki A & Penninger JM. Function of PI3Kgamma in thymocyte development, T cell activation, and neutrophil migration. Science, 287, 1040-1046 (2000)











