
新規質量イメージングを用いたN-アセチルグルコサミン修飾タンパク質の時空間的解析
 |
研究代表者 山本一夫 東京大学大学院新領域創成科学研究科 https://sites.google.com/site/iyakuhome/ |
【研究概要】
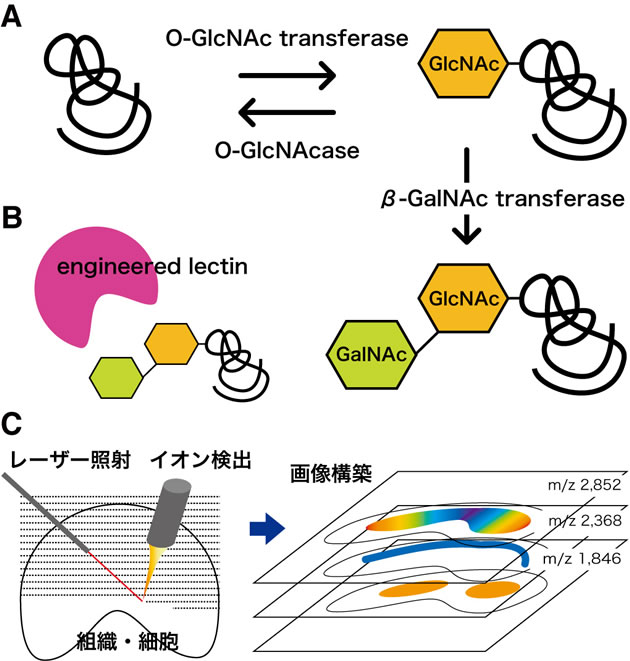
タンパク質の糖鎖修飾の中で、唯一細胞質内で起こる反応が、セリン、スレオニン残基のβ-N-アセチルグルコサミン(O-GlcNAc)修飾である。この糖は伸張反応が起こらず可逆的な反応であり、リン酸化反応と競合してそのシグナル伝達を抑制するメカニズムの1つと漠然と理解されてきた。しかしながら、近年、ヒストンや転写因子などのO-GlcNAc修飾が細胞の分化や増殖、そして活性化を誘導する積極的なシグナルとして関与することを示唆する報告が相次ぎ、メチル化やアセチル化と同様の積極的なシグナル伝達機構の1つとして捉える提案がなされている。この糖鎖修飾は可逆的であることから、僅かなもののみが修飾されているに過ぎず、修飾タンパク質の検出や追跡がきわめて困難である。本研究では、細胞に稀にしか存在しないN-アセチルガラクトサミン転移酵素を核内に発現させることにより、O-GlcNAcを伸長させて安定なO-GlcNAc修飾に導く(図A)。その一方で、マメ科レクチンの糖認識部位をランダムに改変したレクチンライブラリーから、任意の糖鎖と結合する改変レクチンクローンを取得する手法を確立したが、この方法を用いてO-GlcNAc修飾を特異的に認識する改変レクチンを探索する(図B)。この2つの手法を組み合わせ、核内にO-GlcNAc結合性の改変レクチンを発現させることにより、細胞活性化に伴うヒストン等のO-GlcNAc修飾の時間的・空間的な変動を捉えることを目標としている。その追跡手法には、従来の蛍光プローブを用いた手法にとどまらず、マトリックス支援レーザー脱離イオン化質量分析計(MALDI-TOF/TOF MS)を用いた質量イメージングの手法を試みる。質量イメージングは、組織切片全体にマトリックス化合物を噴霧し、連続的にレーザーを照射して分子イオンを検出ことにより、二次元的な分布を質量数毎にイメージング画像として構築する手法である(図C)。この質量分析計は高感度なタンパク質の同定にも適していることから、単に標的分子の細胞内における局在をイメージング画像として構築するだけではなく、その分子と相互作用する他の分子、あるいはその近傍に存在する分子を網羅的に特定する。これにより、時空間的なイメージング画像ばかりでなく、そこに相互作用する分子の動態をも把握し、O-GlcNAc修飾によるシグナル伝達の意義を包括的に理解することを目指す。
参考文献
- N. Suzuki , D. Nawa, T. Su, C. Lin, K. Khoo, K. Yamamoto.: Distribution of the Galb1-4Gal epitope among birds: Species-specific loss of the glycan structure in chicken and its relatives. PLoS ONE 8(3) e59291 (2013).
- Y. Chen, S. Hojo, N. Matsumoto, K. Yamamoto.: Regulation of Mac-2BP secretion is mediated by its N-glycan binding to ERGIC-53. Glycobiology 23, 904-916 (2013).
- S. Qin, D. Hu, K. Matsumoto, K. Takeda, N Matsumoto, Y. Yamaguchi, K. Yamamoto.: Malectin forms a complex with ribophorin I for enhanced association with misfolded glycoproteins. J. Biol. Chem. 287, 38080-38089 (2012)
- J. Park, A. Kanayama, K. Yamamoto, Y. Miyamoto: ARD1 binding to RIP1 mediates doxorubicin-induced NF-kB activation. Biochem. Biophys. Res. Commun. 422, 291-297 (2012).
- Y. Chen, D. Hu, R. Yabe, H. Tateno, S. Qin, N. Matsumoto, J. Hirabayashi, K. Yamamoto.: Role of Malectin in Glc2Man9GlcNAc2-dependent quality control of α1-antitrypsin. Mol. Biol. Cell 22, 3559-3570 (2011)
- T. Satoh, Y. Chen, D. Hu, S. Hanashima, K. Yamamoto, Y. Yamaguchi.: Structural basis for oligosaccharide recognition of misfolded glycoproteins by OS-9 in ER-associated degradation. Mol. Cell 40 905-916 (2010).
- M Nishino, Y Kamiya, T Mizushima, S Wakatsuki, H Sasakawa, K Yamamoto, S Uchiyama, M Noda, K Fukui, HP Hauri, K Kato.: Structural basis for the cooperateve interplay between the two causative gene products of combained factor V and factor VIII deficiency. Proc Natl Acad Sci USA. 107, 4034-4039 (2010)
- N Suzuki and K Yamamoto.: Molecular cloning of pigeon UDP-galactose:b-galactoside α1,4-galactosyltransferase and UDP-galactose:β-galactoside β1,4-galactosyltransferase, two novel enzymes catalyzing the formation of Galα1-4Galβ1-4Galβ1-4GlcNAc sequence. J. Biol. Chem. 285, 5178-5187 (2010)
- N Kawasaki, Y Ichikawa, I Matsuo, K Totani, N Matsumoto, Y Ito, K Yamamoto.: The sugar-binding ability of ERGIC-53 is enhanced by its interaction with MCFD2. Blood 111, 1972-1979 (2008).











